
【题目】已知:(1)NH4++OH-=NH3↑+H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO(2)微溶物在溶液中不能大量存在,会沉淀而析出某强酸性的X 溶液中可能含有 Fe2+、 A13+、 NH4+、 CO32―、 SO32―、 SO42―、 C1―中的若干种,现取 X溶液进行连续实验,实验过程及产物如下:
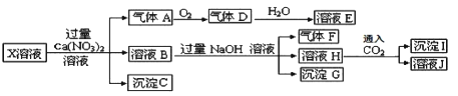
下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是A13+和C1―
【答案】D
【解析】
试题分析:X是强酸性溶液,一定不会含有弱酸根离子:CO32―、SO32―;加入硝酸钙,溶液具有了强氧化性,故气体A是一氧化氮,D是二氧化氮,E则为硝酸,故溶液中一定含有还原性的离子:Fe2+;B中加入氢氧化钠产生了气体F,F一定是氨气,溶液中一定含有铵离子;H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或碳酸钙,故溶液中不一定含有铝离子;沉淀C为硫酸钙,溶液中一定含有硫酸根;A、气体A是一氧化氮,A错误;B、根据分析,X中肯定存在Fe2+、NH4+、SO42-,不能确定是否含有铝离子,B错误;C、E是硝酸,F是氨气,可以发生反应,C错误;D、根据分析可知,溶液中可能含有铝离子和氯离子,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】下列有关有机物化合物的说法正确的是
A. 组成上相差一个或若干个CH2 原子团的有机物化合物之间互称为同系物
B. 石油分馏、催化裂化、裂解等石油加工方法,目的均为得到更多的汽油
C. 甲烷和乙烯都可以与氯气发生取代反应和加成反应
D. 戊烷有三种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C7H8O的芳香族化合物中,与FeCl3溶液混合后显紫色和不显紫色的物质分别
A. 2种和1种 B. 3种和2种 C. 2种和3种 D. 3种和1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.PX项目的主要产品对二甲苯属于饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HCl、HBr、HI的分子间作用力依次减小
B. Si与SiO2都由共价键构成,晶体类型相同
C. NaHSO4在水溶液中或熔融状态下,都能电离出H+
D. 水受热气化成水蒸气吸收的能量主要用于共价键的断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10 △H2>0
CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) ![]() 3C(g)+2D(s) △H>0。达到平衡时生成了1.8 mol C。
3C(g)+2D(s) △H>0。达到平衡时生成了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生影响。回答(3)(4)
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g).下列说法正确的是( )
Na2S(s)+4H2O(g).下列说法正确的是( )
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com