
盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥ C.②⑤⑥ D.全部
D
【解析】
试题解析:①金属单质与酸或某些盐溶液反应可直接生成盐,如铁与盐酸反应生成盐为氯化亚铁,故①能;②碱性氧化物能与酸反应可直接生成盐,如氧化钠与盐酸反应可直接生成氯化钠,故②能;③碱与酸、酸性氧化物、某些盐等可反应生成盐,如氢氧化钠与二氧化碳反应可直接生成碳酸钠,故③能;④非金属单质能与碱反应生成盐,如氯气与氢氧化钠反应生成氯化钠、次氯酸钠,故④能;⑤酸性氧化物能与碱反应生成盐,如二氧化碳与氢氧化钾反应生成碳酸钾,故⑤能;⑥酸能与碱、某些盐、碱性氧化物等反应生成盐,如盐酸与氢氧化钠反应生成氯化钠,故⑥能;显然全部都能在一定条件下直接生成盐,故选D.
考点:常见物质的性质


科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是
A.在80℃ pH= 10的溶液中:Na+ 、CH3CHO、Ag(NH3)2+ 、NO3—
B.溶液中能大量共存,通入CO2后仍能大量共存:K+、Ca2+ 、Cl—、NO3—
C.与镁反应只产生氢气的溶液中:NO3—、Cl—、H+、A13+
D.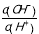 =1.0×10-12溶液中:C6H5O—、K+、SO42—、CH3COO—
=1.0×10-12溶液中:C6H5O—、K+、SO42—、CH3COO—
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
在下列有FeCl3溶液参加的反应中,与Fe3+发生氧化还原反应的是
①FeCl3与Cu反应 ②FeCl3与H2S反应
③FeCl3与KI反应 ④FeCl3滴入沸水中
⑤FeCl3与NaHCO3反应 ⑥FeCl3溶液中滴入石蕊试液
A.③④⑤⑥ B.③④⑤ C.④⑤⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子,在碱性条件下能大量共存,在强酸性条件下发生氧化还原反应的是
A.Mg2+、Na+、SO42-、HCO3—
B.NH4+、Na+、SO42—、NO3—
C.K+、Na+、SiO32—、ClO—
D.Na+、K+、NO3—、SO32—
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】(15分)
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
请根据上述信息回答:
(1)C的名称是__________。B→I的反应类型为_________。
(2)只用一种试剂鉴别D、E、H,该试剂是___________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为___________。
(4)核磁共振氢谱图中D有_______组峰且峰面积之比为 _____________。
(5)D和F反应生成X的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:选择题
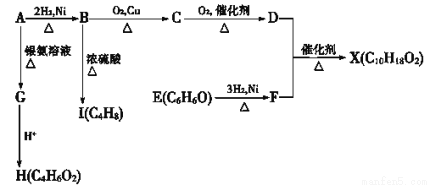
下列各项反应对应的图像错误的是
A.图1:将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体
B.图2:将稀盐酸逐滴加入一定量偏铝酸钠溶液中
C.图3:将二氧化硫逐渐通入一定量氯水中
D.图4:将铜粉逐渐加入一定量浓硝酸中
查看答案和解析>>
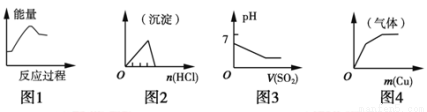
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:实验题
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)试管中发生反应的化学方程式为_____________________________.
(2)能够证明铜与浓硫酸反应生成气体的现象_________________________.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | __________ | ______________ |
写出其中SO2显示还原性的反应的离子方程式___________________.
(4)实验完毕后,先熄灭酒精灯,由于导管E存在,B中的液体不会倒吸入A中,其原因是___________________________________________.
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是_______________________.
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:填空题
(16分)碳及其化合物有广泛的用途。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2) 已知:C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)  CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3) CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) =CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为_______________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4) 将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)________________________。
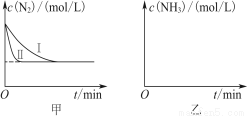
(5) 工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
请回答下列问题:①与实验Ⅰ比较,实验Ⅱ改变的条件为____________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com