
【题目】将2. 80 g部分被氧化成氧化镁的镁条完全溶于50. 0 mL硫酸溶液后,滴加2. 00 mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去200. 0 mL。将所得的沉淀灼烧、冷却后称量得固体质量为4. 40 g。
请计算:
(1)质量为4. 40 g的固体是____________(填化学式)。
(2)镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=____________。
(3)在与50. 0 mL硫酸溶液反应前被氧化的镁的质量是_____________g。
(4)上述硫酸的物质的量浓度c(H2SO4)=_____________mol·Lˉ1。
【答案】MgO 1︰10 0. 24 4. 00
【解析】
将2. 80 g部分被氧化成氧化镁的镁条完全溶于50. 0 mL硫酸溶液后,溶液中存在硫酸镁和可能剩余的硫酸,滴加2. 00 mol·Lˉ1氢氧化钠溶液,氢氧化钠首先与可能剩余的硫酸反应,再与硫酸镁反应生成氢氧化镁沉淀,将所得的沉淀灼烧、氢氧化镁分解生成氧化镁,冷却后称量得固体质量为4. 40 g,为氧化镁,可以计算出镁元素的物质的量,从而确定消耗的氢氧化钠的量,进一步判断是否有硫酸剩余,结合反应方程式和溶液的组成分析解答。
(1)镁和氧化镁与盐酸反应后生成氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁沉淀,灼烧氢氧化镁,氢氧化镁分解生成氧化镁,因此4. 40 g的固体是氧化镁,故答案为:MgO;
(2)设镁条中含有镁和氧化镁的物质的量分别为x、y。则有①24g/mol×x+40g/mol×y=2.80g;4. 40 g氧化镁的物质的量为![]() =0.11mol;即②x+y=0.11mol,联立①②为方程组解得:x=0.1mol,y=0.01mol,镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=0.01mol︰0.1mol= 1︰10,故答案为:1︰10;
=0.11mol;即②x+y=0.11mol,联立①②为方程组解得:x=0.1mol,y=0.01mol,镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=0.01mol︰0.1mol= 1︰10,故答案为:1︰10;
(3)0.01mol氧化镁中镁的物质的量为0.01mol,质量为0.24g,即在与50. 0 mL硫酸溶液反应前被氧化的镁的质量为0.24g,故答案为:0.24;
(4)反应后溶液中的镁离子与氢氧化钠反应生成氢氧化镁沉淀消耗的氢氧化钠为2. 00 mol·Lˉ1×0.2L=0.4mol,镁离子完全沉淀后溶液中含有的溶质为Na2SO4,则反应前硫酸的物质的量为氢氧化钠物质的量的一半,为0.2mol,因此原硫酸的物质的量浓度为![]() =4.00mol/L,故答案为:4. 00。
=4.00mol/L,故答案为:4. 00。


科目:高中化学 来源: 题型:
【题目】NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用装置中a、b均为多孔石墨电极。下列说法正确的是

A. b为电池的负极,发生还原反应
B. 电子流向:a电极→溶液→b电极
C. 一段时间后,b极附近HNO3浓度增大
D. a极的电极反应为NO2+e-+H2O=NO3-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是
选项 | 性质 | 用途 |
A | 次氯酸有强氧化性 | 用作漂白剂 |
B | 氧化铝熔点很高 | 制造耐火坩埚 |
C | 硅有导电性 | 制造光导纤维 |
D | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
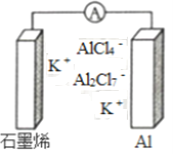
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是
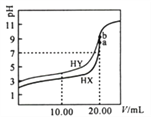
A. 水解常数:X->Y-
B. 10.00mL时,有c(Na+)>c(HX)>c(X-)>c(H+)
C. pH=7时,c(Y-)>c(X-)
D. a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.ⅠA族元素单质的熔点从上往下逐渐降低
B.分子晶体中一定存在共价键
C.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
D.同周期非金属氧化物对应的水化物的酸性从左往右依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若已发现了116号元素则下列推断正确的是:![]() 其钙盐的化学式为CaR;
其钙盐的化学式为CaR;![]() 其最高价氧化物对应的水化物的酸性比硫酸弱;
其最高价氧化物对应的水化物的酸性比硫酸弱;![]() 是金属元素;
是金属元素;![]() 是非金属元素;
是非金属元素;![]() 最外电子层有6个电子
最外电子层有6个电子![]()
A. ①②③ B. ①③⑤ C. ②④⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100 mL无色溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)

下列说法不正确的是( )
A. 原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
C. 原溶液中c(Cl-) ≥0.1mol·L-1
D. 原溶液一定存在Cl-,可能存在Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com