
【题目】氮氧化物(NO2)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | △H1 | △H2 | △H3 |
热量值kJ/mol | 945 | 498 | 630 |
①△H1___0,△H3____0。(填“>”或“<”)
②N2(g)+O2(g)=2NO(g)△H=____kJ·mol-1。
(2)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-l
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g)AH=-1160 kJ·mol-l
H2O(l)=H2O(g)△H=+44kJ·mol-l
CH4与NO2反应生成N2和H2O(l)的热化学方程式为_______。
(3)潜艇中使用的液氮-液氧燃料电池工作原理如图所示:

①电极a名称是______。
②电解质溶液中OH-离子向_____移动(填“电极a”或“电极b”)。
③电极b的电极反应式为_____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是_____。
【答案】> < +183 CH4(g)+2NO2(g)=N2(g)+CO2 (g)+2H2O (l) △H=-955kJ·mol-l 负极 电极a O2 +2H2O +4e-=4OH- 2NH3 +NaClO=N2H4+NaCl+H2O
【解析】
(1)①断键需要吸收能量,即△H1>0,形成化学键,释放能量,即△H3<0;
②△H=△H1+△H2-2△H3=(945kJ·mol-1+498kJ·mol-1-2×630kJ·mol-1)=+183kJ·mol-1;
(2)CH4和NO2发生反应CH4+2NO2=N2+2H2O(l)+CO2,①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g),②CH4(g)+4NO(g)==2N(g)+CO2(g)+2H2O(g),③H2O(l)=H2O(g),根据盖斯定律,得出![]() △H=-955kJ·mol-1,即热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2 (g)+2H2O (l) △H=-955kJ·mol-l;
△H=-955kJ·mol-1,即热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2 (g)+2H2O (l) △H=-955kJ·mol-l;
(3)①根据装置图,电极a上NH3→N2,N的化合价升高,即电极a为负极;
②根据原电池工作原理,OH-向负极移动,即OH-移向电极a;
③电极b的电极反应式为O2+2H2O+4e-=4OH-;
(4)NH3作还原剂,NaClO作氧化剂,NaClO将NH3氧化成N2H4,本身被还原成NaCl,其反应方程式为2NH3+NaClO=N2H4+NaCl+H2O。


科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中盛有 0.18g 镁条,加入 10.00mL2.00mol/L 的硫酸溶液 反应完全后,产生氢气 180mL。
(1)根据实验数据计算,气体的摩尔体积为_____。
(2)反应过程中,装置内空气没有排除,空气的体积对实验结果____(填“有”或“无”)影响,请简述理由:________
(3)有同学认为:若镁条中混有杂质,则实验结果会偏低。请列举实例分析该同学的观点是否正确?____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)

请回答下列问题:
(1)工业上,由石油获得白蜡油的方法是___。
(2)丁烷是由石蜡油求得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(﹣CH3),则这种同分异构体的结构简式是___。
(3)反应B→C反应发生需要的条件为___,D物质中官能团的名称是___。
(4)写出B+D→E的化学方程式___;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有___(写出其中一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:

(1)海带提碘实验中不需要的仪器是_________(选填编号)。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(2)步骤③的实验操作名称是____________;用到的玻璃仪器有(写仪器名称)_____________________________________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤是用有机溶剂将碘从水中提取出来,此过程包含的实验操作是_______________、_______________。不能用酒精代替苯的理由是_________________________(用文字简述)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法(用文字简述):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系式错误的是( )
A. CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-)
B. 等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-) >c(OH-)>c(H+)
C. NaHCO3溶液中存在水解平衡:HCO3-+H2OH2CO3+OH-
D. 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数) ![]() +
+![]() + c(OH-)
+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”—钛酸钡(BaTiO3)![]() 的工艺流程如下:
的工艺流程如下:
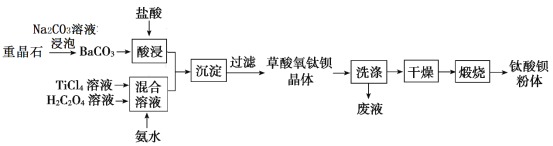
已知:
(1)Ksp(BaSO4)=1.0×10﹣10 ,Ksp(BaCO3)=5.0×10-9
(2)草酸氧钛钡晶体的化学式为 BaTiO(C2O4)2·4H2O
回答下列问题:
(1)为提高BaCO3的酸浸速率,可采取的措施为_________(写出一条)。
(2)配制一定浓度的TiCl4溶液时,通常是将TiCl4(室温下为液体)________________。
(3)用Na2CO3溶液泡重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为BaCO3,此反应的平衡常数K=______(填写计算结果)。若不考虑CO32-的水解,则至少需要使用浓度为_____mol/LNa2CO3溶液浸泡重晶石才能开始该转化过程。
(4)设计实验方案验证草酸氧钛钡晶体已经洗涤干净:______________________________。
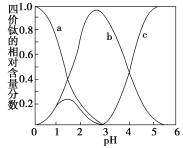
(5)“混合溶液液”环节,钛元素在不同pH下主要以TiOC2O4、TiO(C2O4)22-和TiO(OH)+三种形式存在,如图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则图中曲线a对应钛的形式为_____(填化学式);写出“沉淀”时的离子方程式:___________。
(6)煅烧草酸氧钛钡晶体得到BaTiO3方程式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分离方法的叙述中,不正确的是 ( )
A.用过滤的方法分离溶液和胶体
B.用四氯化碳萃取碘水中的碘
C.用蒸馏的方法将自来水制成蒸馏水
D.用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)═2NO(g)+O2(g)在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示反应达到平衡状态的是
A. ①③⑤ B. ②④⑥ C. ②③④⑥ D. ①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com