

���� ��Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪBe����ΪC����ΪN����ΪO����ΪF����ΪNa����ΪAl����ΪCl����ΪAr��
��1��H��ԭ�Ӱ뾶��С��Na��ԭ�Ӱ뾶���ϡ�������������ȶ���F�ķǽ�������ǿ��������Ϊ���к�������������ǿ���
��2�������������Ϊ������̼����������ȼ�ղ����������ƣ�
��3�����õ��ұ��Na������Ũ��������������Ʊ����������ʢ��뵥�ʢߵ�����������Ӧ��ˮ���ﷴӦ����ƫ�����ƺ�������
��� �⣺��Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪBe����ΪC����ΪN����ΪO����ΪF����ΪNa����ΪAl����ΪCl����ΪAr��
��1�������ֱ�ע��Ԫ����ԭ�Ӱ뾶��С���Ǣ٣��뾶�����Ǣߣ���ѧ�������ȶ����Ǣ⣬�ǽ�������ǿ���Ǣޣ�����������Ӧ��ˮ����������ǿ���Ǣᣬ
�ʴ�Ϊ���٣��ߣ��⣻�ޣ��
��2�������������Ϊ������̼���ṹʽΪO=C=O����������ȼ�ղ����������ƣ������ʽΪ ��
��
�ʴ�Ϊ��O=C=O�� ��
��
��3�����õ��ұ��Na����ӦΪ2NaCl�����ڣ�$\frac{\underline{\;���\;}}{\;}$2Na+Cl2��������Ũ��������������Ʊ���������ӦΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�����ʢ��뵥�ʢߵ�����������Ӧ��ˮ���ﷴӦ����ƫ�����ƺ����������ӷ�ӦΪ2Al+2OH-+2H2O=2AlO2-+3H2����
�ʴ�Ϊ��2NaCl�����ڣ�$\frac{\underline{\;���\;}}{\;}$2Na+Cl2����MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��2Al+2OH-+2H2O=2AlO2-+3H2����
���� ���⿼��λ�á��ṹ�����ʵ�Ӧ�ã�Ϊ��Ƶ���㣬����Ԫ�ص�λ�á����ʼ�Ԫ�ػ�����֪ʶΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl | B�� | H2O | C�� | H2O2 | D�� | C2H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
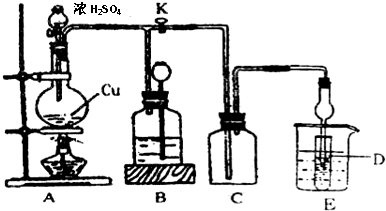
| �����Ʋ� | ʵ�鲽�輰���� |
| �ף�������Fe��OH�� 3���� �ң����������ϣ����ܷ�����Ӧ��Fe3++6SO2?Fe��SO2��63+ ����Ӧb�� | �����Ʊ�Fe��OH�� 3���岢���� �����ֱ���Fe��OH�� 3����ú��ɫҺ���м����������ۣ���ǰ�߲���ɫ�����߱�Ϊdz��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ܶ�С��Һ̬ˮ | B�� | ������Һ�� | ||
| C�� | HF�ķе����HI | D�� | �л����ձ����ͬ���칹���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ������2��̼ԭ�Ӷ���sp2�ӻ� | B�� | ��ϩ���Ӵ��ڷǼ��Լ� | ||
| C�� | ��ϩ������4��Hԭ����ͬһƽ���� | D�� | ��ϩ������6���Ҽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
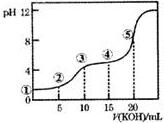 �����£���0.10mol•L-1��KOH����Һ�ζ�10.00mL0.10mol•L-1��H2C2O4����Ԫ���ᣩ��Һ���õζ�������ͼ��ʾ������˵����ȷ���ǣ�������
�����£���0.10mol•L-1��KOH����Һ�ζ�10.00mL0.10mol•L-1��H2C2O4����Ԫ���ᣩ��Һ���õζ�������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �����ʾ��Һ�У�c��H+��/c��OH-��=1012 | |
| B�� | �����ʾ��Һ�У�c��K+����c��HC2O4-����c��H2C2O4����c��C2O42-�� | |
| C�� | �����ʾ��Һ�У�c��K+��+c��H2C2O4��+c��HC2O4-��+c��C2O42-��=0.1mol•L-1 | |
| D�� | �����ʾ��Һ�У�c��OH-��=c��H+��+c��HC2O4-��+c��H2C2O4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �û����Һ���У�c��Na+��+c��H+��=c��HC2O4-��+c ��OH-��+2 c ��C2O42-�� | |
| B�� | �û����Һ���У�c ��Na+��=2 ��c��HC2O4-��+c ��H2C2O4��+c ��C2O42-���� | |
| C�� | �û����Һ���У�c ��OH-��-c��H+��=c��HC2O4-��+2 c ��H2C2O4�� | |
| D�� | �û����Һ���У�c ��Na+����c ��C2O42-����c��HC2O4-����c ��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com