
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
 SO2 CaO+SO2====CaSO3 2CaSO3+O2====2CaSO4
SO2 CaO+SO2====CaSO3 2CaSO3+O2====2CaSO4

科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.①②③④⑤ | B.②④⑤ | C.①④⑤ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
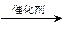 CH3COOC2H5
CH3COOC2H5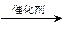 CH3CHO
CH3CHO| A.②③④ | B.①②④ | C.①③④ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该氮的氧化物所含电子数为偶数 |
| B.该氮的氧化物可由Cu与浓HNO3反应获得 |
| C.氮的氧化物是自然固氮的一种产物 |
| D.氮的氧化物中氮元素的质量分数为0.636 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
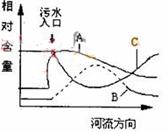
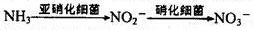 ⑷氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下: ,某同学在该地工业园区取得水样,准备检测其中无机氮的含量,查阅工具书后,决定先检测水样中的铵或氨的浓度,反应原理为2K2[HgI4]+NH4Cl+4KOH==(OHg2NH2)I(红色)+KCl+7KI+3H2O,用比色法测定。
⑷氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下: ,某同学在该地工业园区取得水样,准备检测其中无机氮的含量,查阅工具书后,决定先检测水样中的铵或氨的浓度,反应原理为2K2[HgI4]+NH4Cl+4KOH==(OHg2NH2)I(红色)+KCl+7KI+3H2O,用比色法测定。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2 | B.CO2 | C.NO | D.NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.③④ | C.① | D.②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com