
【题目】在一密闭烧瓶中充满NO2,在25℃时NO2与N2O4达到平衡:2NO2![]() N2O4ΔH﹤0,把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是
N2O4ΔH﹤0,把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是
A.颜色B.平均分子量C.物质的量D.密度
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性比HB弱,在物质的量浓度均为0.1mol·L-1的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列所示装置不能达到有关实验目的的是( )
A.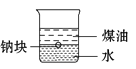 用该装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
用该装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B. 用该装置可检验HCO3-与CO32-结合H+的难易
用该装置可检验HCO3-与CO32-结合H+的难易
C.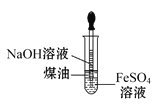 用该装置制备Fe(OH)2
用该装置制备Fe(OH)2
D.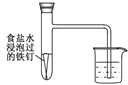 该装置探究钢铁的吸氧腐蚀
该装置探究钢铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气成分有多种,乙酸苯甲酯(![]() )是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)B的结构简式分别为___;反应⑤的反应类型分别为___。
(2)写出反应①、③的化学方程式:
①____;
③____。
(3)反应___(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(4)符合下列条件的乙酸苯乙酯的同分异构体的数目有___个
I、能发生银镜反应 II、能发生水解反且水解产物能与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
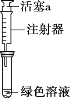
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO
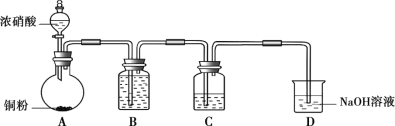
①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的A、B、C、D、E、F、G均为有机物。

据上图回答问题:
(1)D的名称为:___;
(2)A的结构简式是___;
(3)反应③的化学方程式是:___;
(4)符合下列3个条件的B的同分异构体的数目有___个;
I、含有二取代苯环结构 II、与B有相同官能团 III、不与FeCl3溶液发生显色反应。写出其中属于邻二取代苯环结构的任意一个同分异构体的结构简式___;
(5)B不仅可以生成E,还可以在一定条件下形成高分子化合物,写出B形成高分子化合物的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)![]() 2CO(g)平衡常数K的表达式为_______________;
2CO(g)平衡常数K的表达式为_______________;
已知C(s) + H2O(g)![]() CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)![]() CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为_____________________。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为_____________________。
(2) 已知某温度下,反应2SO2+O2![]() 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)= 1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应__________(填“是”或“否”)达到化学平衡状态,若未达到,向__________(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)![]() cC(g)+dD(g) △H =akJ·mol-1;
cC(g)+dD(g) △H =akJ·mol-1;
若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
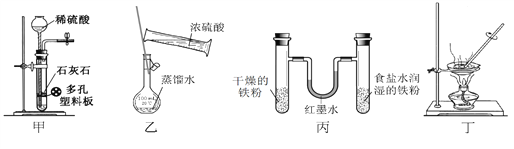
A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com