
| A、H++OH-═H2O |
| B、CO32-+2H+═H2O+CO2↑ |
| C、Zn(OH)2+2H+═Zn2++2H2O |
| D、Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓ |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
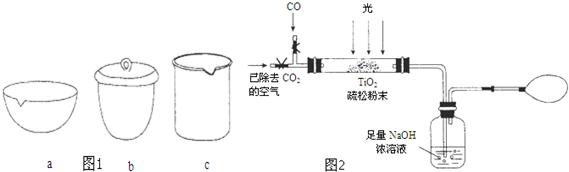
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=12的溶液中:K+,Na+,AlO2-,S2-,SO32- |
| B、无色溶液中:K+,Cl-,MnO4-,PO43-,SO42- |
| C、水电离的H+浓度C(H+)=10-12mol?L-1的溶液中:ClO-,SO42-,NO3-,NH4+,Na+ |
| D、某强酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸铜钡可用氧化物形式表示为BaO?CuO?2SiO2 |
| B、强酸、强碱均可将硅酸铜钡(BaCuSi2O6)完全溶解 |
| C、将CO2通入硅酸钠溶液中,可形成硅酸溶胶 |
| D、泡花碱可以用作防火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
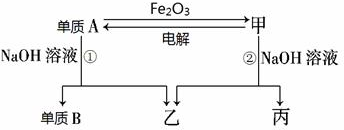
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol?L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
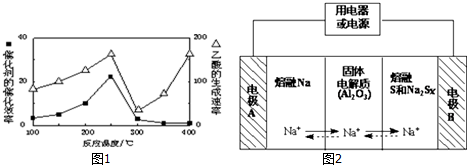
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com