
| m |
| M |
| n |
| V |
| m |
| n |
| 5.4g |
| 27g/mol |
| 3 |
| 2 |
| 0.3mol |
| 0.2L |
| 32g |
| 0.4mol |
| 32x+16y |
| x+y |
| 3 |
| 1+3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
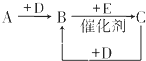 A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
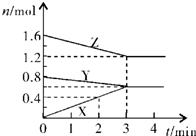 Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.
Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.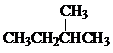 和
和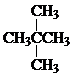
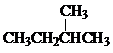 和
和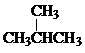
| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(1)2H2(g)+O2(g)=2H2O(g) | ||||
B、
| ||||
C、C(s)+
| ||||
| D、S(s)+O2(g)=SO2(g) S(g)+O2(g)=SO2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com