

| ||
| ||


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
| A、少量的CO2通人氨水中:CO2+NH3?H2O═NH4++HCO3- | ||||
| B、Na2O2溶于水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | ||||
| C、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | ||||
D、用惰性电极电解熔融氯化钠:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
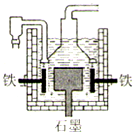 钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
| ||
| ||
| A、制取等物质的量最的金属钠转移电子的物质的量关系是:Ⅰ=Ⅱ=Ⅲ |
| B、Ⅰ法制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| C、Ⅱ法制钠的原理是利用铁的还原性比钠强 |
| D、Ⅲ法制钠的电解槽装置如图,工作时电解槽的铁电极与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
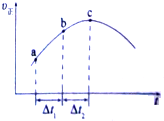 自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )
自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )| A、反应物浓度:a点小于c点 |
| B、△t1=△t2时氢气的产率:ab段小于bc段 |
| C、该反应的正反应为吸热反应 |
| D、c点反应进行的程度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下面是关于药物华素片(西地碘片)使用说明中的部分内容:
下面是关于药物华素片(西地碘片)使用说明中的部分内容:| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片.将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等. [贮藏]遮光、密闭、在凉处保存. [有效期]二年 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的△H<0,△S<0 |
| B、向溶液中加少许KCl 固体或少许KOH固体平衡不移动 |
| C、对溶液所在体系加热,溶液红色变浅 |
| D、增大压强,反应混合物的颜色不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com