
| A. | 甲一定是烷烃 | |
| B. | 乙的物质的量为0.05mol | |
| C. | 符合条件的乙的可能结构有3种(包含顺反异构) | |
| D. | 甲的质量为2.4g |
分析 M(混合)=13×2g/mol=26g/mol,摩尔质量小于26g/mol的只有甲烷,所以混合气体中一定含有甲烷,溴水增重2.8g为另一种不饱和烃的质量,计算甲烷的质量,进而计算该不饱和烃的物质的量,再计算其摩尔质量,利用商余法确定另一种烃,据此进行解答.
解答 解:M(混合)=13×2g/mol=26g/mol,烃类中摩尔质量小于26g/mol的只有甲烷,则混合气体中一定含有甲烷;
n(混合)=$\frac{4.48L}{22.4L/mol}$=0.2mol,混合气体质量为:0.2mol×26g/mol=5.2g,
溴水增重2.8g为另一种烃的质量,则甲烷的质量为5.2g-2.8g=2.4g,甲烷的物质的量为:$\frac{2.4g}{16g/mol}$=0.15mol;
则另一种烃的物质的量为:0.2mol-0.15mol=0.05mol,另一种不饱和烃的摩尔质量为:$\frac{2.8g}{0.05mol}$=56g/mol,根据商余法:$\frac{56}{14}$=4,则另一种烃为丁烯,
故该混合物为甲烷与丁烯,其中甲的相对分子质量小于乙,则甲为甲烷、乙为丁烯,
A.根据分析可知,甲为甲烷,故A正确;
B.根据计算可知,乙的物质的量为0.05mol,故B正确;
C.乙为丁烯,丁烯存在1-丁烯、2-丁烯和2-甲基-1-丙烯,其中2-丁烯存在顺反异构,则最多含有4种同分异构体,故C错误;
D.根据分析可知甲的质量为2.4g,故D正确;
故选C.
点评 本题考查有机物分子式确定的计算,题目难度中等,根据混合气体的摩尔质量判断含有甲烷是解答本题的关键,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
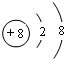 ,C的原子结构示意图为
,C的原子结构示意图为 .
. ,A与D的化合物的电子式为
,A与D的化合物的电子式为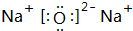 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| C. | 决定化学反应速率的主要因素是温度 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的百分含量不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | v正(X)=2v逆(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 二氧化碳电子式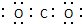 | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Bi3Ge3O15 | B. | Bi4Ge3O12 | C. | Bi4Ge3O16 | D. | Bi3Ge3O12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| B. | 常温下,铁和稀硝酸反应:2Fe+6HNO3═2Fe(NO3)3+3H2↑ | |
| C. | 碳酸氢钠和过量稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com