
下列说法不能证明H2(g)+I2(g) 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是
A.一个H—H 键断裂的同时有两个H—I键断裂
B.恒温恒容时,某一生成物浓度不再变化
C.恒温恒容时,混合气体颜色不再变化
D.恒温、压强一定,体积可变的容器,混合气体的密度不再变化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
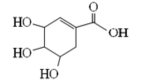
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是 ( )
A.分子式为C7H6O5 B.分子中含有两种官能团
C.可发生加成和取代反应
D.在水溶液中羟基和羧基均能电离出氢离子
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
|
| A. | 多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 |
|
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
|
| C. | 食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
|
| D. | 日本福岛核电站爆炸时释放的2种放射性同位素131I与137Cs的中子数不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法错误的是
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.物质W3X4中,每个原子最外层均达到8电子稳定结构
C.X、Y和氢形成的化合物中可能既有离子键、又有共价键
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是
A.该反应的化学方程式为3X+Y===2Z
B.2 min时,反应达最大限度,但化学反应仍在进行
C.反应开始至2 min,Z的反应速率为0.05 mol·L-1·min-1
D.反应达到平衡时,压强是开始时的0.9倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6[来源:学科网ZXXK] | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平衡反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30 mol/L
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。下图3
—3为阳离子交换膜法电解原理示意图:
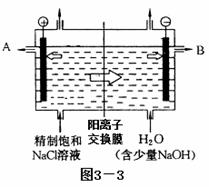 请回答下列问题:
请回答下列问题:
(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是 。(填“吸氧腐蚀”或“析氢腐蚀”)
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是 。
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O  NaClO3 + 3H2↑
NaClO3 + 3H2↑
C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(4)已知某电解槽每小时加入10%的氢氧化钠溶液a kg,每小时能产生标准状况下的氯气b L,则电解后流出的氢氧化钠溶液(密度为d g·cm-3)的物质的量浓度为(理论计算,需化简) mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com