
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W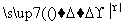 X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W:________、X:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
离子方程式:____________________________________________________________。
化学方程式:___________________________________________________________。
(1)NaHCO3 Na2CO3 NaOH Na2O2 (2)②③ Na2O2 Na2O2 (3)Ca2++CO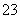 ===CaCO3↓
===CaCO3↓
Ca(OH)2+K2CO3===CaCO3↓+2KOH
解析 本题中4种未知物W、X、Y、Z是钠的化合物,而钠的化合物主要有Na2O、Na2O2、NaOH和钠盐,这就给思考本题划定了范围,在具体分析给出的反应式时,要选条件充分、又具特色的反应式作为突破口。反应式②、③给出了Z跟CO2、H2O的反应,这两个反应都有氧气生成,具备这一条件的钠的化合物只能是过氧化钠,由此可确定Z是Na2O2,相关的化学方程式是:
2Na2O2+2CO2===2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2↑
由此可确定X是Na2CO3,Y是NaOH,这一判断又可由反应式④加以证实,即
Na2CO3+Ca(OH)2===2NaOH+CaCO3↓
再依据反应式①W分解产物是Na2CO3、CO2、H2O,说明W是NaHCO3,化学方程式是2NaHCO3△,Na2CO3+H2O+CO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
两种气态烃以任意比例混合,在105 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
( )。
A.CH4与C2H4 B.CH4与C3H4
C.C2H2与C3H6 D.C2H4与C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,其中由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,则参加反应的NaOH的物质的量为________;原NaOH溶液的物质的量浓度为________;生成标准状况下H2的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
BPO是使面粉增白的一种添加剂。分子结构中有两个苯环的BPO只含有C、H、O三种元素,其相对分子质量不超过250,氧元素的质量分数约为26.45%。BPO可通过下列方法得到(反应条件略):
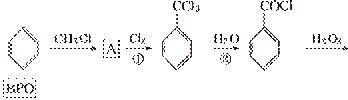
(1)写出A的结构简式____________,反应①的反应类型为__________。
(2)写出反应②的化学方程式________________________________________________。
(3)BPO具有对称的分子结构且分子中含有过氧键(—O—O—),但不能发生银镜反应,试写出BPO的结构简式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。下列说法正确的是
( )。
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
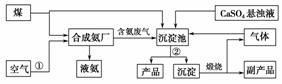
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生 素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如下:
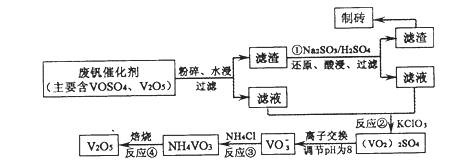
请回答下列问题。
(1)工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式: 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。X为 (写化学式)。
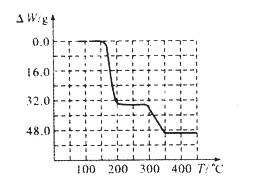
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化 的曲线如上图所示。则NH4VO3在分解过程中 (填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com