
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
分析 分子式为C5H10O2且与NaHCO3溶液能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,-C4H9的种类等于该有机物的异构体数目.
解答 解:分子式为C5H10O2且与NaHCO3能产生气体,则该有机物中含有-COOH,所以为饱和一元羧酸,烷基为-C4H9,-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,故符合条件的有机物的异构体数目为4,故选B.
点评 本题主要考查同分异构体书写、官能团的性质与确定等,侧重于学生的分析能力的考查,难度中等,熟练掌握碳原子数小于5的烃基的个数是解决本题的关键,甲基与乙基均1种,丙基2种、丁基4种、戊基8种.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 若a<b,则c(OH-)<c(H+) | B. | 若a>b,则c(NH4+)>c(Cl-) | ||
| C. | 若a>b,则c(OH-)>c(H+) | D. | 若a=b,则c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
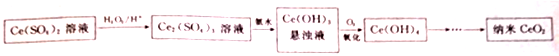
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融烧碱时不能使用石英坩埚:SiO2+2NaOH$\stackrel{△}{→}$ Na2SiO3+H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+→I2+O2↑+4H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) $\stackrel{高温}{→}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+→Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
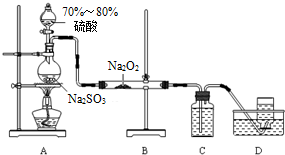
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com