
| A、K+ Na+ Cl- NO3- |
| B、Cu2+ H+ HCO3- Cl- |
| C、Na+ Ba2+ Cl- SO42- |
| D、Fe2+ H+ NO3- ClO- |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Na+、Ba2+、Fe2+、Al3+ |
| 阴离子 | Cl-、OH-、AlO2-、NO3-、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、阳极的电极反应式是N2+6H++6e-═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、③⑥ |
| C、②④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实际产量 |
| 理论产量 |
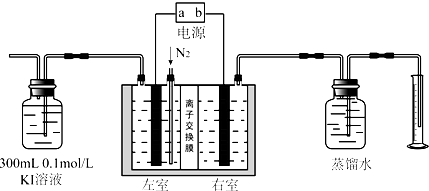
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与0.01mol?L-1NaOH溶液等体积混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、缺铁会患贫血症 |
| B、为防治佝偻病,过量补钙 |
| C、摄入糖分不足,会患低血糖 |
| D、缺碘人群可多食用海带、虾皮等含碘丰富的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com