
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ + 6HCHO = 3H++ 6H2O + (CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤 Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大” 、“偏小”或“无影响”)。
、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
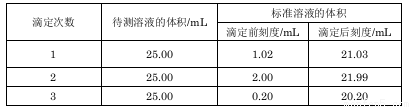
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮元素的质量分数为 。(结果保留四位有效数字)
科目:高中化学 来源:2017届重庆市高三上12月考前测试化学卷(解析版) 题型:选择题
用NaOH滴定pH 相同、体积相同的H2SO4
相同、体积相同的H2SO4 、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体
、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体 积依次为V1、V2、V3,则这三者的关系是( )
积依次为V1、V2、V3,则这三者的关系是( )
A.V1>V2>V3 B.V1<V2<V3 C.V1=V2>V3 D.V1=V2<V3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上段考二化学试卷(解析版) 题型:选择题
己知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是
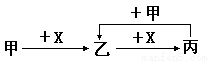
A.甲为c,X为O2 B.甲为SO2,X为NaOH溶液
C.甲为Al2O3,X为NaOH溶液 D.甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高一上期中化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
①将金属Na投入醋酸中:2Na+2 CH3COOH=2Na++2CH3COO- +H2↑
②向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO32--+2H+=CO2↑+H2O
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高一上期中化学试卷(解析版) 题型:选择题
下列离子能大量共存的是
A.无色酚酞试液呈红色的溶液中:Na+ 、K+、SO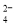 、CO
、CO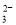
B.无色透明的溶液中:Cu2+、K+、SO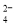 、NO
、NO
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH 、SO
、SO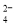 、Cl-
、Cl-
D.紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上月考二化学试卷(解析版) 题型:选择题
已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是:
A.a = b
B.混合溶液的pH = 7
C.混合溶液中,c(H+) =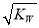 mol/L
mol/L
D.混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上月考二化学试卷(解析版) 题型:选择题
以下有关溶液(均在常温下)的结论正确的是:
 A.pH=1的盐酸与pH=5的盐酸等体积混合后pH=3
A.pH=1的盐酸与pH=5的盐酸等体积混合后pH=3
B.0.1 mol/L醋酸溶液100 mL与0.2 mol/L氨水50 mL混合后能恰好完全中和
C.pH>7的溶液中不可能存在CH3COOH分子
D.等浓度等体积的KOH溶液和CH3COOH溶液混合后:c (CH3COO-)=c (K)+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上阶段测二化学卷(解析版) 题型:选择题
在H2SO3+2H2S = 3H2O+3S反应中,被氧化与被还原元素的质量比为( )
A.1:1 B.2:1 C.1:2 D.3:2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:填空题
(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是_______________.
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程式是_______________.
(3)对比(1)和(2)实验所得的结果,将Cl-、I-、SO2按还原性由强到弱顺序排列为_______________.
(4)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①当有0.2mole-转移时被氧化的HCl的质量是_______________;
②如果将20mL12mol•L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将_______________.
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com