
| A. | 实验室保存电石时应注意密封,并置于阴凉干燥处 | |
| B. | 上述反应产生1molC2H2气体在常温常压下体积为2.24L | |
| C. | 电石与水反应不是氧化还原反应 | |
| D. | 产物C2H2属于有机物 |
分析 A.电石易与水反应生成乙炔,应密封保存,并置于阴凉干燥处;
B.标准状况下,气体摩尔体积为22.4L/mol;
C.有元素化合价发生变化的反应属于氧化还原反应;
D.有机物是含碳的化合物,有些含碳化合物性质与无机物相同一般也是无机物,如一氧化碳、二氧化碳、碳酸钙等,产物C2H2属于有机物.
解答 解:A.电石易与水反应CaC2+2H2O═Ca(OH)2+C2H2↑,生成乙炔,应密封保存,并置于阴凉干燥处,故A正确;
B.在常温常压下,1molC2H2的体积大于22.4 L,故B错误;
C.元素化合价没有发生变化,不是氧化还原反应,故C正确;
D.有机物是含碳的化合物,有些含碳化合物性质与无机物相同一般归为无机物范畴,如一氧化碳、二氧化碳、碳酸钙等,产物C2H2属于有机物,属于常见的有机物中的炔烃,故D正确;
故选B.
点评 本题考查电石的性质,侧重于物质的性质的考查,有利于培养学生良好的科学素养,难度不大,注意气体的体积与物质的状态有关,掌握物质的分类.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与SO2完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5 NA | |
| D. | 常温常压下,3gHCHO和CH3COOH的混合物中含有0.4NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe 和Zn | B. | Al和Cu | C. | Na和Mg | D. | Mg和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
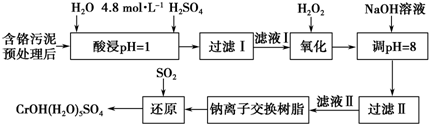
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com