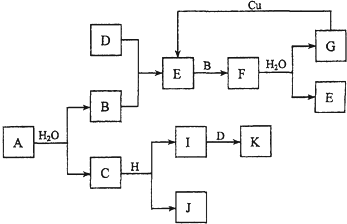
解答:
解:通常状况下,A是淡黄色固体,能与水反应生成C及单质气体B,则A为Na
2O
2,B为O
2,C为NaOH,H是金属单质,能与氢氧化钠溶液反应生成J与气体单质I,则H为Al、J为NaA1O
2、I为H
2.F是红棕色气体,则F为NO
2,由E与氧气反应得到,则E为NO,气体单质D与氧气反应得到NO,则D为N
2,K为NH
3,二氧化氮与水反应生成G为NHO
3,
(1)由上述分析可知,A为Na
2O
2,J为NaA1O
2,故答案为:Na
2O
2;NaA1O
2;
(2)实验室用氢氧化钙与氯化铵反应制备氨气,反应方程式为:Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O,
故答案为:Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O;
(3)G→E的化学方程式为:3Cu+8HNO
3(稀)=3Cu(NO
3)
2+2NO↑+4H
2O;此反应中,氧化剂为硝酸,由生成的NO可知,起氧化剂作用的硝酸占参加反应的
,还原剂为Cu,氧化剂与还原剂的物质的量之比是 2:3,
故答案为:3Cu+8HNO
3(稀)=3Cu(NO
3)
2+2NO↑+4H
2O;2:3;
(4)检验NaOH中钠离子的实验方法是:焰色反应,
故答案为:焰色反应;
(5)实验室中保存的NaOH溶液可能会变质,会含有碳酸钠,检验是否含有碳酸根即可确定是否变质,
a.若向样品变质,滴加稀硝酸会有气体生成,故a正确;
b.若样品变质,滴加氢氧化钡溶液,会有白色沉淀产生,故b正确;
c.氢氧化钠溶液呈碱性,碳酸钠溶液也呈碱性,向样品中滴加酚酞试液,无论是否变质,溶液都变为红色,故c错误;
d.氢氧化钠与氯化镁得到氢氧化镁沉淀,碳酸钠与氯化镁得到碳酸镁沉淀,向样品中滴加氯化镁溶液,无论是否变质都生成白色沉淀,故d错误,
故答案为:ab;
(6)同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH
3、②NO
2,进行喷泉实验,经充分反应后,
①中溶液体积等于氨气的体积,溶液物质的量浓度=
=
mol/L;
②中发生反应:3NO
2+2H
2O=2HNO
3+NO,3体积二氧化氮反应得到1体积NO,硝酸溶液体积为NO
2体积的
,假设NO
2的体积为VL,则生成硝酸的物质的量为
×
=
×
mol,故硝酸溶液浓度=
=
mol/L,
故溶液的物质的量浓度为①=②,
故答案为:=.