
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 体积相同、密度相等的CO和N2O | D. | 压强相同、体积相同的O2和H2 |
分析 两种气体的分子数一定相等,根据N=nNA可知,二者物质的量相等.
A.根据PV=nRT,可知温度、体积相同情况下,压强影响气体物质的量;
B.根据n=$\frac{m}{M}$判断;
B.根据m=ρV、n=$\frac{m}{M}$判断;
D.根据PV=nRT,可知等压等体积下温度影响气体物质的量.
解答 解:两种气体的分子数一定相等,根据N=nNA可知,二者物质的量相等.
A.根据PV=nRT可知,等温等体积下影响气体物质的量的因素为压强,二者压强不一定相等,故含有分子数目不一定相等,故A错误;
B.N2和C2H4的摩尔质量都是28g/mol,二者质量相等,根据n=$\frac{m}{M}$可知二者物质的量相等,含有分子数目相等,故B正确;
C.体积相同、密度相等的CO和N2O,根据m=ρV可知二者质量相等,但二者摩尔质量不相等,再根据n=$\frac{m}{M}$可知物质的量不等,含有分子数目不相等,故C错误;
D.根据PV=nRT可知,等压等体积下影响气体物质的量的因素为温度,二者温度不一定相等,故含有分子数目不一定相等,故D错误,
故选B.
点评 本题考查阿伏伽德罗定律及推论,根据pV=nRT理解阿伏伽德罗定律及推论、理解温度及压强对气体摩尔体积的影响,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳、氮氧化物是酸雨形成的主要因素 | |
| B. | 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O | |
| C. | 含铅化合物导致人体蛋白质变性是物理变化 | |
| D. | 固体悬浮微粒是造成雾霾天气的一种重要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素属于无机化合物 | |
| B. | 青蒿素属于氧化物 | |
| C. | 标准状况下,1mol青蒿素的体积约为22.4L | |
| D. | 青蒿素的摩尔质量为282g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是配制一定物质的量浓度的溶液的专用仪器 | |
| B. | 容量瓶可以用来加热 | |
| C. | 能用容量瓶贮存配制好的溶液 | |
| D. | 可以用500mL容量瓶配制250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.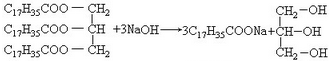 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 任何元素的原子都是由核外电子和核内中子、质子组成 | |
| D. | ${\;}_{17}^{35}Cl$与${\;}_{17}^{37}Cl$得电子能力相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com