
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 1:3 |
分析 根据热化学方程式可知CO、氢气的燃烧热,然后设出一氧化碳和氢气的物质的量,分别根据总质量、放出热量列式计算出二者的物质的量;相同条件下气体体积之比等于物质的量之比,据此可计算出混合气体中一氧化碳和氢气的体积之比.
解答 解:根据反应2CO(g)+O2(g)=2CO2(g)△=-586.7kJ•mol-1、2H2(g)+O2(g)=2H2O(l)△=-571.6kJ•mol-1可知,CO的燃烧热为293.35kJ/mol,H2的燃烧热为285.8kJ/mol,
设混合气体中CO与H2的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{28x+2y=5.8}\\{293.35x+285.8y=87.25}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.2mol}\\{y=0.1mol}\end{array}\right.$,
相同条件下气体体积与物质的量成正比,则混合气体中CO和H2的体积比=0.2mol:0.1mol=2:1,
故选B.
点评 本题考查了热化学方程式的计算,题目难度不大,明确热化学方程式的书写原则及表示意义为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 共生成0.1mol氧化钙 | |
| B. | 煅烧越充分则消耗的盐酸越少 | |
| C. | 共生成0.1mol二氧化碳 | |
| D. | 煅烧后固体中氧元素的质量分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 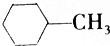 的一氯代物最多有4种 的一氯代物最多有4种 | |
| B. | 乙酸可与乙醇、金属钠、新制Cu(OH)2悬浊液等物质反应 | |
| C. | Cl2可与乙烷发生取代反应,与乙烯发生加成反应 | |
| D. | 阿托酸(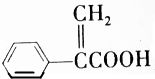 )可用于合成高分子材料 )可用于合成高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向某种化学肥料中加入熟石灰混合、研磨 | 没有氨味 | 该化学肥料一定不是氮肥 |
| B | 点燃某种纤维材料 | 无烧焦羽毛的气味 | 该纤维一定是合成纤维 |
| C | 向一未知溶液中加入稀盐酸 | 有无色气泡产生 | 该溶液中一定含有CO32- |
| D | 向一未知溶液中先滴加足量稀盐酸,再滴加BaC12溶液 | 先无现象,后产生白色沉淀 | 原溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
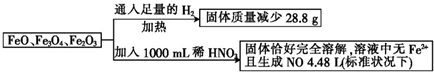
| A. | 4.0 mol•L-1 | B. | 4.4 mol•L-1 | C. | 4.8 mol•L-1 | D. | 3.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
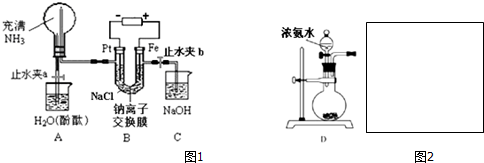
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,元素D在元素周期表中的位置是第三周期VIIA族.
,元素D在元素周期表中的位置是第三周期VIIA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com