

| n(CO2) |
| n(NaOH) |
| 1 |
| 2 |
| n(CO2) |
| n(NaOH) |
| n(CO2) |
| n(NaOH) |
| 1 |
| 2 |
| 1 |
| 2 |
| n(CO2) |
| n(NaOH) |
| n(CO2) |
| n(NaOH) |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一上学期期中考试化学试卷 题型:实验题
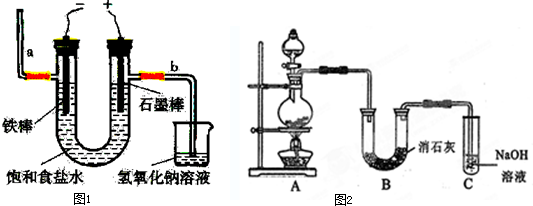
(20分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气:观察下图,回答:
Ⅰ(1)若饱和食盐水中含有酚酞,通电后_____(填a或b)侧先变红。
(2)电解反应的化学方程式为__________________
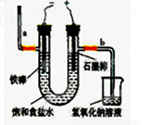
Ⅱ某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为 ,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
(2) 漂白粉将在U形管中产生,其化学方程式是 。
(3) C装置的作用是 。
(4) 此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(用化学方程式表示) 。为避免此副反应的发生,可将装置作何改进 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 。
A.食盐 B.食醋 C.烧碱 D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气。
I.工业上通常采用电解法制氯气:观察右图,回答:

(1)若饱和食盐水中通电后b侧产生的气体通入NaOH溶液中所发生的反应的离子方程式为 。
(2)电解反应的化学方程式为 。
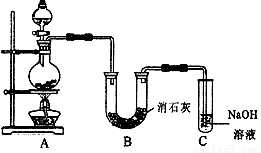
II.某学生设计如右图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为 ▲ ,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 ▲ 。
(2)漂白粉将在U形管中产生,其化学方程式是 ▲ 。
(3)C装置的作用是 ▲ 。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 ▲ 。
②试判断另一个副反应(用化学方程式表示) ▲ 。为避免此副反应的发生,可将装置作何改进 ▲ 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 ▲ 。
A.食盐 B.食醋 C.烧碱 D.纯碱
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州中学高一上学期期中考试化学试卷 题型:实验题
(20分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气:观察下图,回答:
Ⅰ(1)若饱和食盐水中含有酚酞,通电后_____(填a或b)侧先变红。
(2)电解反应的化学方程式为__________________
Ⅱ某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: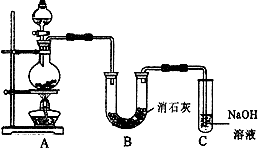
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为  ,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
(2) 漂白粉将在U形管中产生,其化学方程式是 。
(3) C装置的作用是 。
(4) 此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是 。
2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(用化学方程式表示) 。为避免此副反应的发生,可将装置作何改进 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 。
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com