
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
分析 I.(1)化学平衡常数为平衡时,生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)温度不变,利用浓度商与化学平衡常数的大小,判断平衡移动方向,得到答案;
Ⅱ.(3)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(4)分析压强对化学反应速率和化学平衡的影响,得到答案;
Ⅲ.(5)电解质能在高温下能传导O2-,负极发生氧化反应,即C8H18)失去电子生成CO2,根据质量守恒和电荷守恒写出电极反应式;
(6)原子利用率等于期望产物的总质量与生成物的总质量之比.
解答 解:I.(1)反应物和生成物浓度不变时,达到平衡状态,3min后达到平衡状态,容器体积为1L,则c(H2O)=0.350mol/L,c(CO)=0.150mol/L,c(H2)=c(CO2)=0.600mol/L-0.350mol/L=0.250mol/L,化学平衡常数表达式为:K=$\frac{[CO{\;}_{2}]•[H{\;}_{2}]}{[CO]•[H{\;}_{2}O]}$=$\frac{0.250×0.250}{0.350×0.150}$=1.2,
故答案为:1.2;
(2)向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mol H2,各物质浓度分别为:0.5mol/L、0.5mol/L、1mol/L、1mol/L,浓度商=$\frac{1×1}{0.5×0.5}$=4>1.2,平衡向逆反应方向移动,所以υ(正)<υ(逆),
故答案为:<;
Ⅱ.(3)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$②得反应CO(g)+2H2(g)=CH3OH(l),该反应的反应热△H═-283.0kJ•mol-1+(-286kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-129kJ•mol-1,CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1;
(4)增加压强,缩小体积,反应物浓度增大,反应速率加快,正反应速率加快大于逆反应速率,化学平衡向正反应方向移动,故答案为:增加压强使反应速率加快,同时平衡右移,CH3OH产率增大;
(5)电解质能在高温下能传导O2-,负极发生氧化反应,即1molC8H18失去电子生成CO2,共失去8×[+4-(-$\frac{18}{8}$)]=50mole-,18molH原子转化为9molH2O,根据质量守恒和电荷守恒写出电极反应为:C8H18-50e-+25O2-=8CO2+9H2O,
故答案为:C8H18-50e-+25O2-=8CO2+9H2O;
(6)原子利用率等于期望产物的总质量与生成物的总质量之比,反应b中理论上原子利用率为:$\frac{46}{88+12}$×100%=46%,
故答案为:46%.
点评 本题考查影响化学平衡的因素、化学平衡的建立等,难度较大,构建平衡建立的途径进行比较是关键,探讨了能源的循环利用和温室效应的解决,着重考查了物质催化反应的过程,结合考查了化学反应速率和对图表的理解解析能力,综合能力要求较高,另外读图时要注意观察横纵坐标的含义和单位,难度中等.


科目:高中化学 来源: 题型:选择题
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是( )| A. | 原溶液一定含有Na2SO4 | |
| B. | 反应最后形成的溶液中的溶质为NaCl | |
| C. | 原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32- | |
| D. | 原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中,先加入氯水后滴入KSCN溶液,若溶液呈红色,则说明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取待测液放在火焰上灼烧,若火焰呈黄色,则说明待测液中含有钠离子,不含钾离子 | |
| C. | 分液时,分液漏斗中下层液体从下口放出后,将上层液体从上口倒入另一个洁净的烧杯中 | |
| D. | 蒸馏时,应将温度计的水银球插入蒸馏烧瓶内的混合液体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
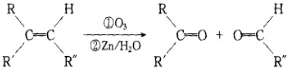
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题:
X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素处于最高价态时一定有强氧化性 | |
| B. | 含氧酸的价态越高,氧化性一定越强 | |
| C. | 金属元素被还原,不一定得到金属单质 | |
| D. | 氧化还原反应的本质是元素化合价的升降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com