
| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
科目:高中化学 来源: 题型:选择题

| A. | 在 pH 为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应 HCO3-+H2O?H2CO3+OH-的平衡常数为 10-7.63 | |
| C. | 0.1 mol•L-1NaHC2O4溶液中 c(HC2O4-)+2c(C2O42-)+c(H2C2O4)=0.1 mol•L-1 | |
| D. | 往 Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
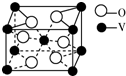 钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.
钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 晶胞是晶体结构中的基本结构单元 | |
| B. | 根据晶体的不同,晶胞可以是多种形状的几何体 | |
| C. | 晶胞一般都是平行六面体 | |
| D. | 晶胞都是正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
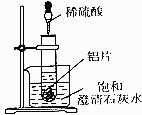 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量盐酸 | B. | 加热 | ||
| C. | 加少量醋酸钠晶体 | D. | 加少量NaOH晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com