
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)| 1 |
| 2 |
| 1 |
| 2 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、试剂X可以是盐酸 |
| B、反应①过滤后所得沉淀为氢氧化铁 |
| C、图中所示转化反应都不是氧化还原反应 |
| D、操作②中发生的化学方程式为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
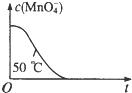
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| B、含有CO32-的澄清透明溶液中:K+、NO3-、Cl-、Na+ |
| C、在pH=2的溶液中:ClO-、SO32-、Na+、K+ |
| D、能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
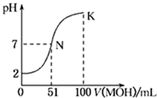 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、N点水的电离程度小于K点水的电离程度 |
| C、K点所示溶液中c(A-)>c(M+) |
| D、K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | 蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2008年11月6日 |
| A、富含蛋白质的是鲜鸡蛋 |
| B、富含维生素的是脱水青菜和橙汁 |
| C、富含淀粉的是面粉和白砂糖 |
| D、富含油脂的是精炼食用植物油和奶油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com