
【题目】某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤10t,计算:
(1)如果煤中的硫全部转化为SO2 , 每天可产生的SO2的质量为多少t;
(2)这些SO2在标准状况下的体积.
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解产物,某学生设计了如下实验方案: 
回答下列问题:
(1)试剂1是 , 作用是;
(2)试剂2是 , 作用是 , 发生的离子反应为:; 如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的 , 若不能,其原因是 .
(3)如何检验第①步实验已基本完成 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,不会出现丁达尔效应的是
①稀豆浆 ②蒸馏水 ③硫酸铜稀溶液 ④FeCl3稀溶液 ⑤云雾
A.②④⑤B.①③④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜在生产、生活中应用广泛.某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如图: 
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: .
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 .
(3)滤渣c是 .
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为 2NO+O2═2NO2、 .
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3):n(SO2)=1:2,写出硫酸铜受热分解的化学方程式: .
(6)某同学设计了如图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积.此设计有不合理之处,请说明理由: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。
(1)实验室制备原料气NO和Cl2的装置如下图所示:
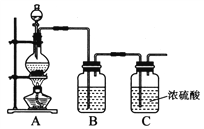
实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_______。装置B中盛放的试剂为_______,其作用为___________________。
(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______。
②装置D中发生的反应方程式为__________________。
③如果不用装置E会引起什么后果______________________。
④某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____,为了充分吸收尾气,可将尾气与_______同时通入氢氧化钠溶液中。
(3)工业上可用间接电化学法除去NO,其原理如下图所示,吸收塔中发生的反应为:NO+S2O42+H2O→N2+HSO3

①吸收塔内发生反应的氧化剂与还原剂物质的量之比为_________________。
②阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F六种化合物,其中A,B,C,D,E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_______
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色,且用激光笔照射有丁达尔效应。 |
写出B与稀H2SO4反应的离子方程式________
写出②中反应的化学方程式________
(3)现由6种粒子Mn2+、MnO 4-、H+、H2O、X2Y 82-(C中含有的阴离子)、XY 42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO 4- 需氧化剂的物质的量为________ mol
(4)化合物D和E相互转化D ![]() E,若有D和ExH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为________ g,ExH2O的化学式为________.
E,若有D和ExH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为________ g,ExH2O的化学式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由美国《科学》杂志评出的2008年十大科学进展中的四项研究,主要属于化学探究领域的是( )
A.观测太阳系外行星
B.绘制癌症基因图谱
C.研制高温超导材料
D.计算物质世界重量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
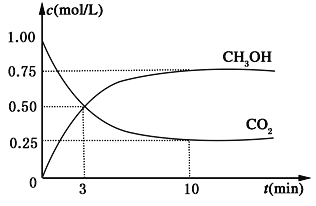
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________mol/(L·min);
(2)氢气的转化率=________________________;
(3)反应过程中,下列能说明该反应达到平衡状态的是______________________。
a.体系压强保持不变
b.混合气体密度保持不变
c.混合气体的平均相对分子质量保持不变
d.CO2的消耗速率等于CH3OH的生成速率
e.CO2与CH3OH的物质的量浓度相等
(4)该反应的平衡常数为__________________________ (保留小数点后2位);
(5)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol H2
(6)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com