
25��ʱ��������ĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | CH3COOH | HClO | H3PO3 |
���� | ���� | ������ | ������ |
����ƽ�ⳣ�� | 1.8��10-5 | 3.0��10-8 | K1=8.3��10-3 K2=5.6��10-6 |
�ش��������⣺
��1��Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��HClO�� H3PO3��Һ�У�c��H+����С����__________��
��2�������ᣨH3PO3��Ϊ��Ԫ�ᣬ���н�ǿ�Ļ�ԭ�ԡ�H3PO3�ĵ��뷽��ʽΪ___________��Na2HPO3��________�����ʽ�Ρ�����ʽ�Ρ������Ρ�����
��3�������£�0.1mol/L��CH3COOH��Һ��ˮϡ�͵Ĺ����У����б���ʽ����ֵһ��������_______������ĸ����
A��c��H+�� B��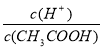 C��c��CH3COO- �� D��c��CH3COOH��
C��c��CH3COO- �� D��c��CH3COOH��
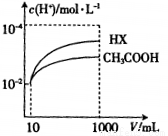
��4�������Ϊ10mL��c��H+����Ϊ10-2mol/L�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ������c��H+���ı仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��_________������ڡ���С�ڡ����ڡ�������ĵ���ƽ�ⳣ����
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017������ʡ������Э�������������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���Ƶ�˼ά�����ڻ�ѧѧϰ���о�����ʱ���������Ľ��ۣ��������Ƴ��Ľ�������Ҫ����ʵ���ļ�����ܾ�������ȷ����������ƽ�������ȷ���ǣ� ��
A��Cu��Cl2ֱ�ӻ�������CuCl2��Cu��Sֱ�ӻ���Ҳ�ܵõ�CuS
B��Fe3O4��д��FeO��Fe2O3��Pb3O4Ҳ��д��PbO��Pb2O3
C��Mgʧ������CO2���Naʧ��Ҳ������CO2���
D����ҵ�ϵ������MgCl2��ȡ����þ��Ҳ�õ������AlCl3�ķ�����ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ���˹����е���У�����ϵ�һ��������ѧ���������棩 ���ͣ�ѡ����
����˵����һ�������¿���ʵ�ֵ���
������������������Ӧ
������������Һ��Ӧ������ǿ��
��û��ˮ���ɣ�Ҳû�г������������ɵĸ��ֽⷴӦ
����������Һ��ַ�Ӧ�����Һ������
���е��ʲμӵķ�������ԭ��Ӧ
�����ֺ��������ﷴӦ�IJ���������
A���٢ڢۢܢݢ� B���ڢܢݢ� C���٢ڢۢ� D���ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ���������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ǿ������Һ�У������������ܴ�����������ҺΪ��ɫ�����ǣ� ��
A��Na+��K+ ��OH ����Cl�� B��Na+��Cu2+��SO42����NO3��
����Cl�� B��Na+��Cu2+��SO42����NO3��
C��K+��Mg2+��SO42����Cl�� D��Ba2+��HCO3����NO3����K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ���������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼΪ��������Ҫ�ɷ�ʾ��ͼ������˵������ȷ����( )

A��SO2��NxOy����������������
B�������ڽ���,�ܲ��������ЧӦ
C���ؽ������ӿɵ��µ����ʱ���
D������β���Ĵ����ŷ������������������Ϊ����֮һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ����У�߶������л�ѧ���������棩 ���ͣ�ѡ����
ij�¶��£���Ӧ:H2��g�� + CO2��g��  H2O��g��+CO��g����ƽ�ⳣ��K =9/4���¶��£��ڼס������������ܱ������У�Ͷ��H2��g����CO2��g��������ʼŨ�����±���ʾ��
H2O��g��+CO��g����ƽ�ⳣ��K =9/4���¶��£��ڼס������������ܱ������У�Ͷ��H2��g����CO2��g��������ʼŨ�����±���ʾ��
��ʼŨ�� | �� | �� |
c��H2��/mol • L-1 | 0.010 | 0.020 |
C��CO2��/mol��L-1 | 0.010 | 0.010 |
�����ж���ȷ����
A��ƽ��ʱ����������H2��ת����Ϊ60%
B��ƽ��ʱ����������H2��ת���ʴ���60%
C��ƽ��ʱ����������c��H2���Ǽ������е�2��
D����Ӧ��ʼʱ���������еķ�Ӧ���ʱ��������еķ�Ӧ���ʿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ����У�߶������л�ѧ���������棩 ���ͣ�ѡ����
��NAΪ�����ӵ���������ֵ������˵����ȷ����
A��3.2 g�����к��е���ԭ����Ϊ0.2NA
B��0.1 mol���к��е�̼̼˫����ĿΪ0.3NA
C��1 L 0.1 mol/LCH3COOH��Һ�к��е���ԭ����Ϊ0.1NA
D����״���£�22��4 L�����к��е�HC1������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���ຣʦ���и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��ȷ����
A������ˮ��Ӧ��2Na + 2H2O= 2Na++ 2OH? + H2?
B����������ͭ��Һ�ķ�Ӧ��2Na +Cu2+ = 2Na+ + Cu
C������ϡ����ķ�Ӧ��2Fe+6H+=2 Fe 3+ + 3H2?
D�����ۺ�����������Һ�ķ�Ӧ��2Al+2 OH?= 2AlO2?+ H2?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����a molFeBr2����Һ��ͨ��x molCl2�����и���ͨ��Cl2����Һ�ڷ�����Ӧ�����ӷ���ʽ�����в���ȷ����
A����x=0.4a��2Fe2++Cl2=2Fe3++2Cl-
B����x=0.6a��2Br-+Cl2=Br2+2Cl-
C����x=a��2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D����x=1.5a��2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com