
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族。
(2)反应①的离子方程式为 ;
反应②的离子方程式为 ;
反应③的离子方程式为 ;
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式 ;
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
【答案】(1)![]() ,四,Ⅷ;
,四,Ⅷ;
(2)2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
2Al+2OH-+2H2O=2AlO![]() +3H2↑;
+3H2↑;
Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
②ClO-+2I-+2H+=I2+Cl-+H2O,35.75%。
【解析】
试题分析:根据问题(3),推出C为氯气,因此是电解饱和食盐水,X为NaCl,A为氢气,Y为NaOH,D和NaOH产生H2,则D为Al,K为AlCl3,M为Al(OH)3,E和盐酸反应生成氢气,则E为金属,N是金属氯化物,E和Cl2反应,说明E是变价金属,即E为Fe,N为FeCl3,H为FeCl2,(1)NaOH属于离子化合物,其电子式为![]() ;(2)①根据上述推断,离子反应方程式为:2Cl-+2 H2O
;(2)①根据上述推断,离子反应方程式为:2Cl-+2 H2O ![]() 2OH-+Cl2↑ + H2↑;反应②的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应③的离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)①制取漂白粉,用氯气和氢氧化钙的反应,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,②ClO-+2I-+2H+=I2+Cl-+H2O ,建立关系式ClO- ~I2~2Na2S2O3,m(Ca(ClO)2)=20×10-3×0.1×250×143/(2×2×25)g=0.715g,则漂白粉的有效成分质量分数为0.715/2×100%=35.75%。
2OH-+Cl2↑ + H2↑;反应②的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应③的离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)①制取漂白粉,用氯气和氢氧化钙的反应,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,②ClO-+2I-+2H+=I2+Cl-+H2O ,建立关系式ClO- ~I2~2Na2S2O3,m(Ca(ClO)2)=20×10-3×0.1×250×143/(2×2×25)g=0.715g,则漂白粉的有效成分质量分数为0.715/2×100%=35.75%。


科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的氢氧化钠溶液的体积关系如图所示。
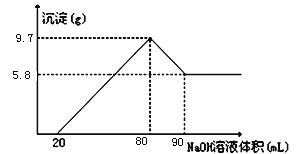
(1)当沉淀达到最大值时,A1(0H)3的物质的量:
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,氦气、氢气和氨气(NH3)的体积比为3∶2∶1,则其原子个数比为
A. 1∶2∶3 B. 4∶3∶3 C. 3∶4∶4 D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡含碳元素的化合物都是有机化合物
B.烃是指仅含碳和氢两种元素的有机物
C.烃是指燃烧后生成二氧化碳和水的有机物
D.所有的有机物均难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.0.012kg12C所含的碳原子数就是阿伏伽德罗常数
B.等质量的O2和O3中所含氧原子的物质的量相同
C.等物质的量的分子所含原子数目一定相等
D.标准状况下,1molH2的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验室加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤 B、溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤、 D.溶解、洗涤、过滤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
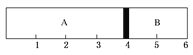
(1)A室混合气体的物质的量为________,所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列与化学有关的说法正确的是
A. 胺态氮肥和草木灰混合使用可增加肥效
B. 氢氟酸刻蚀水晶饰品体现其酸性
C. 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法
D. 煤经过气化和液化等物理变化可转为清洁能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com