
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
分析 (1)酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;
(2)酸性强弱为CH3COOH>H2CO3>HClO>HCO3-,强酸能够制取弱酸,据此对各选项进行判断;
(3)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;
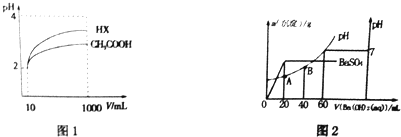
(5)①根据图象知,当混合溶液pH=7时,说明酸中氢离子和碱中氢氧根离子的物质的量相等,据此计算氢离子浓度;
当20mL时硫酸和氢氧化钡恰好反应生成硫酸钡,据此计算硫酸根离子浓度,结合电荷守恒计算氯离子浓度;
③根据A点溶液中氢离子浓度计算溶液的pH.
解答 解:(1)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,
故答案为:a>b>d>c;
(2)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:c、d;
(3)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的比值减小,故a错误;
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大,故b正确;
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以$\frac{c({H}^{+})}{Kw}$的比值减小,故c错误;
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$的比值减小,故d错误;
故答案为:b;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,
根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+),
故答案为:大于;大于;
(5)①由图象知,当pH=7时,消耗Ba(OH)2溶液体积为60mL,由于n(H+)=n(OH-),得c(H+)=$\frac{0.05mol/L×0.06L×2}{0.02L}$=0.3 mol•L-1;
当加入20mLBa(OH)2溶液时,硫酸根离子完全反应,根据原子守恒得c(SO4 2- )=c(H2SO4)=0.05mol/L,
溶液呈电中性,根据电荷守恒得c(Cl-)+2c(SO4 2- )=c(H+),c(Cl-)=c(H+)-2c(SO4 2- )=0.3 mol•L-1-2×0.05mol/L=0.2 mol•L-1,
故答案为:0.3mol•L-1;0.2mol•L-1;
②A点c(H+)=$\frac{0.3mol/L×0.02L-2×0.05mol/L×0.02L}{0.04L}$=0.1mol/L,所以pH=1,
故答案为:1.
点评 本题考查酸碱混合溶液定性判断,为高频考点,题目难度中等,涉及离子浓度大小比较、pH的简单计算等知识,试题知识点较多、综合性较强,充分考查学生分析判断能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子有可能都在一条直线上 | B. | 有5个碳原子可能在一条直线上 | ||
| C. | 6个碳原子一定都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA | |
| B. | 同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 | |
| C. | 1 mol•L-1的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 11.2 L氧气中所含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH•H2O | B. | NaOH | C. | Na2O2•2H2O | D. | Na2O2•8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含有食品添加剂的食物对人体健康均有害 | |
| B. | 石油分馏、煤的气化、海水晒盐、碱去油污等过程都是化学变化 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图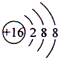 | B. | 乙酸的结构简式:C2H4O2 | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$CL | D. | 二氧化碳分子的比例模型是: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
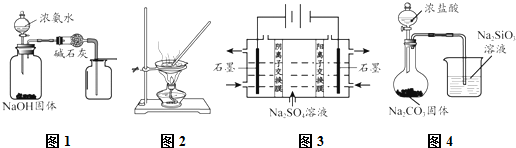
| A. | 用图1所示装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 用图3所示装置制硫酸和氢氧化钠 | |
| D. | 用图4所示装置比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2NH4Cl+Ba(OH)2•H2O═BaCl2+2NH3↑+10H2O | |
| B. | 2HI(g)═H2(g)+I2(g)△H=+14.9 kJ.mol-1 | |
| C. | 形成化学键时共放出能量862 kJ的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com