
在容积可变的密闭容器中,1molN2和4molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
A.5% B.10% C.15% D.20%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.共价键的键能越大,分子晶体的熔点越高
B.失去电子难的原子获得电子的能力一定强
C.在化学反应中,某元素由化合态变为游离态,则该元素一定被还原
D.电子层结构相同的不同简单离子,其半径随核电荷数增多而减小
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:选择题
有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y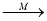 乙酸乙酯,下列说法错误的是
乙酸乙酯,下列说法错误的是
A.X可用新制的氢氧化铜悬浊液检验
B.实验室由Y和M制取乙酸乙酯时可用饱和NaOH溶液来提纯
C.由Y生成乙酸乙酯的反应属于取代反应
D.可用碘水检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol?L-1,向该溶液中逐滴加入0.010 mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42- B.CrO42-、Br-、Cl- C.Br-、Cl-、CrO42- D.Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
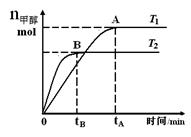
A.平衡常数K = 
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时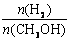 增大
增大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是
A.负极反应式为:H2+2OH- -2e- =2H2O
B.正极反应式为:O2 +4H+十4e- =2H2O
C.工作一段时间后,KOH溶液的浓度不变
D.电池工作时,电子由正极通过外电路流向负极
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:填空题
[化学——物质结构与性质](13分)
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ 氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
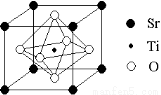
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ 氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
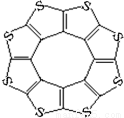
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:选择题
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。关于混合粉末的组成判断正确的是
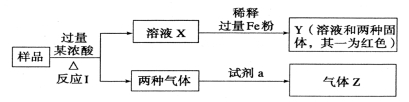
A.一定含CuO和C B.一定含Fe2O3、CuO和C
C.一定含CuO和C,一定不含Al D.气体Z为纯净物
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
A.Cl2 B.KMnO4 C.HCl D.FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com