
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
分析 8NH3+6NO2═7N2+12H2O中,氨气为还原剂,二氧化氮为氧化剂,则由N原子守恒可知7molN2中,3mol为还原产物,4mol为氧化产物,即该反应中还原产物比氧化产物少1mol,同时转移电子为24e-,以此来解答.
解答 解:8NH3+6NO2═7N2+12H2O中,氨气为还原剂,二氧化氮为氧化剂,则由N原子守恒可知7molN2中,3mol为还原产物,4mol为氧化产物,即该反应中还原产物比氧化产物少1mol,同时转移电子为24e-,
A.若还原产物比氧化产物少0.1mol,转移电子为2.4mol,转移电子2.4NA个,故A错误;
B.若还原产物比氧化产物少0.1mol,生成单质为0.7mol,标况下体积为0.7mol×22.4L/mol=15.68L,故B错误;
C.若还原产物比氧化产物少0.1mol,还原剂为0.8mol,氧化剂为0.6mol,还原剂比氧化剂多0.2mol,故C正确;
D.氧化剂被还原,由选项C可知,被还原的氮原子是0.6mol×14g/mol=8.4g,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、基本概念及转移电子为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题
 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏伽德罗常数是指1mol物质中所含有的原子数 | |
| B. | 微粒的数目与物质的量成正比 | |
| C. | 国际上规定0.012kg12C中所含碳原子数为阿伏伽德罗常数 | |
| D. | 1mol O2中的分子数为NA,而原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
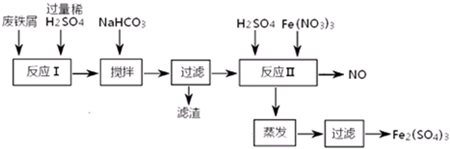
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com