
分析 (1)配制溶液时,溶解和转移溶液需要用到玻璃杯,根据操作方法分析玻璃杯的作用;
(2)根据Fe2(SO4)3和CuSO4的浓度计算混合液中硫酸根离子的浓度;
(3)①加入过量铁粉后,Fe与硫酸铁反应生成硫酸亚铁,铁与硫酸铜反应生成硫酸亚铁和铜,结合反应特点分析反应类型;
②铁粉过量,反应后溶液中含有金属阳离子为亚铁离子,结合检验亚铁离子的方法分析.
解答 解:(1)配制溶液过程中,溶解固体需要用玻璃杯搅拌,转移溶液需要用玻璃杯引流,
故答案为:搅拌;引流;
(2)该混合溶液中c(SO42-)=3c[Fe2(SO4)3]+c(CuSO4)=0.10mol/L×3+0.10mol×1=0.4mol/L,
故答案为:0.40;
(3)①向混合液中加入过量铁粉后,Fe与Fe2(SO4)3和CuSO4分别发生反应的离子方程式为:2Fe3++Fe═3Fe2+、Cu2++Fe═Fe2++Cu,其中属于化合反应的为2Fe3++Fe═3Fe2+,
故答案为:2Fe3++Fe═3Fe2+;
②反应后还有铁单质剩余,则反应后金属阳离子为Fe2+,检验Fe2+离子的方法是:,取反应后溶液的样品,向其中滴加几滴KSCN溶液,溶液不变色,再向其中滴加氯水,溶液变为红色,则证明溶液中所含金属阳离子为Fe2+,
故答案为:取反应后溶液的样品,向其中滴加几滴KSCN溶液,溶液不变色,再向其中滴加氯水,溶液变为红色,则证明溶液中所含金属阳离子为Fe2+.
点评 本题考查较为综合,涉及溶液配制、物质的量浓度的计算、离子检验等知识,题目难度不大,明确发生反应的实质为解答关键,注意掌握溶液配制的方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
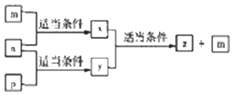 A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B | |
| C. | 原了半径:D>C>B>A | |
| D. | B与同族元素的氧化物可发生置换反应,并且做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素化合价为+2价 | |
| B. | H2O2在该反应中做还原剂 | |
| C. | NaCN中含有离子键和极性共价键 | |
| D. | 生成0.1 mol NH3时,有0.2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中滴加AgNO3溶液产生白色沉淀 | |
| B. | 氯水滴到红色布条上,布条褪色,说明Cl2具有漂白性 | |
| C. | Cl2与H2O发生的反应属于离子反应,其离子方程式是Cl2+H2O=H++Cl-+HClO | |
| D. | Cl2与H2O发生的反应属于氧化还原反应,其中Cl2既做氧化剂又做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )
25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )| A. | 点 ①②之间一定为c(Na+)>c(CH3COOO-)>c(OH-)>c(H+) | |
| B. | 点 ③处有c(Na+)=c(CH3COOO-)+c(CH3COOH) | |
| C. | 点①②③④处水的电离程度由大到小的顺序额为 ②③④① | |
| D. | 点④处有c(H+)+c(CH3COOH)=2c(OH-)-c(CH3COOO-) |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,下图所示为海水综合利用部分流程,有关说法正确的是

A.上述工艺流程中涉及到化合、分解、复分解和置换反应
B.①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2
C.③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2
D.④中反应的离子方程式为SO2+Br2+2H2O===4H++SO42-+2Br-
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:选择题
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作 | 现象 | |
A | 加入NaOH溶液 | 有红褐色沉淀 |
B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
C | 加入酸性KMnO4溶液 | 紫色褪去 |
D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com