
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
(1)从以上元素中选择,在自然界中有游离态存在的有
元素(填元素符号).
(2)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H
2O
2溶液,右边充满滴有KSCN溶液的FeCl
2溶液(足量),一段时间后可观察到的现象:右边
(从下列选项中选择)
A.无明显现象 B.溶液由浅绿色变红色 C.溶液由无色变黄色 D.溶液由浅绿色变无色左边发生反应的离子方程式:
;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH
4Al(SO
4)
2的溶液,右边充满含3mol Ba(OH)
2的溶液,当有2mol SO
42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为
.
(3)某初级石墨中含SiO
2(7.8%)、Al
2O
3(5.1%)、Fe
2O
3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N
2后,在1500℃下与Cl
2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl
4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为
.
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有
;然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式
.

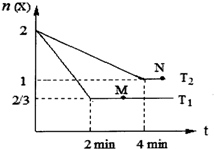 在1L密闭容器中充入2molX,发生反应:X(g)?Y(g)+Z(g)△H,在不同的温度下X的物质的量n(X)随时间变化如图,下列说法正确的是( )
在1L密闭容器中充入2molX,发生反应:X(g)?Y(g)+Z(g)△H,在不同的温度下X的物质的量n(X)随时间变化如图,下列说法正确的是( )

 53随堂测系列答案
53随堂测系列答案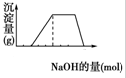 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知,①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知,①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知, 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体. 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )