
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )
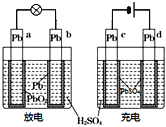
A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数可用NA表示,下列叙述中正确的是( )
A.1mol H2O所含的原子数为NA个
B.16g O2-含有的电子数为10NA个
C.常温常压下,11.2L Cl2所含分子数为0.5NA个
D.1L 1mol/L NaClO溶液中含ClO-个数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO3水溶液中存在电离平衡H2SO3![]() H++ HSO3- 和HSO3-
H++ HSO3- 和HSO3-![]() H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
A.通入氯气,溶液中氢离子浓度增大
B.通入过量H2S,反应后溶液pH减小
C.加入氢氧化钠溶液,平衡向右移动,pH变小
D.加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
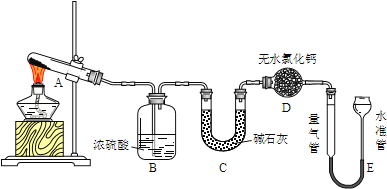
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
① | T1 | 0.640 | 0.320 | 0 | 0 |
② | T2 | 0.640 | 0 | 0.256 | V2 |
③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(1)实验过程中A中的现象是______.D中无水氯化钙的作用是_______.
(2)在测量E中气体体积时,应注意先_______,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积______(填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是_____.实验②中E中收集到的气体是______.
(4)推测实验②中CuSO4分解反应方程式为:_______.
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=_______g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
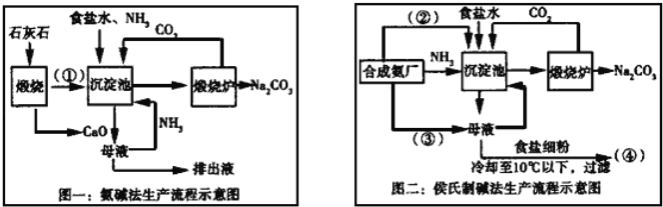
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
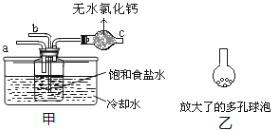
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
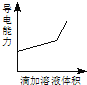
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢与浓硫酸发生如下反应:H2S+H2SO4(浓)→S↓+SO2↑+2H2O加热条件下,单质硫与浓硫酸又会发生如下反应:S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
计算:
(1)若98%浓硫酸可表示为H2SO4aH2O,则a=__;若要把该浓硫酸转化为H2SO4H2O,则98%浓硫酸与加入水的质量比为_____。
(2)一定条件下,将0.1mol H2S气体通入足量浓硫酸中,生成b mol SO2,则 b的取值范围是_______。
(3)在50mL、4.0mol/L的NaOH溶液中,通入H2S气体并充分反应,然后,小心蒸发,得到不含结晶水的白色固体.通入H2S的物质的量为x mol,生成的白色固体的质量为7.9g,通过计算确定白色固体的可能成分及每种成分的质量(结果保留一位小数)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机化合物的结构简式如图所示。有关该物质的说法中正确的是( )
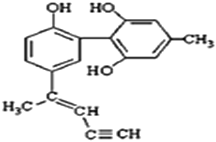
A.该物质有四种官能团,其中一种名称为羟基
B.该分子中的所有碳原子不可能共平面
C.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
D.1 mol该物质与H2反应时最多消耗H2 9 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com