
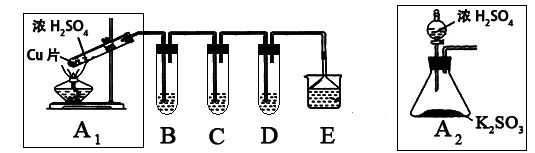
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴(或少量)品红(1分),再滴入过量2mol/L盐酸,振荡(1分) | 若品红褪色(或有气泡),则“吸收液”中存在 SO32-。(1分) |
| 步骤3:用试管取适量滤液(1分),向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液 [或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡(1分)。 | 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-。 (1分) |
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴(或少量)品红(1分),再滴入过量2mol/L盐酸,振荡(1分) | 若品红褪色(或有气泡),则“吸收液”中存在 SO32-。(1分) |
| 步骤3:用试管取适量滤液(1分),向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液 [或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡(1分)。 | 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-。 (1分) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
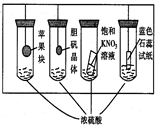
| A.苹果块会干瘪 |
| B.胆矾晶体表面有“白斑” |
| C.小试管内有KNO3晶体析出 |
| D.蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2SO4
H2SO4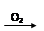 SO2
SO2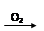 SO3
SO3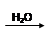 H2SO4
H2SO4| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- |
| D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
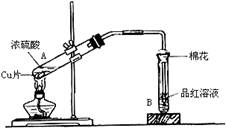
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用浓硝酸除去铝制品表面的铜镀层 |
B.用催化法处理汽车尾气中的CO和NO:CO+NO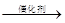 C+NO2 C+NO2 |
| C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 |
| D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
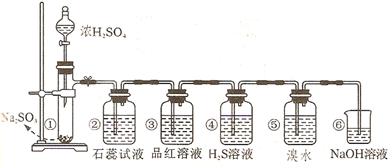
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
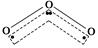
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因浓硫酸具有强氧化性,故不可用它来干燥氢气 |
| B.浓硫酸不活泼,可用铁铝容器存放 |
| C.浓硫酸有强氧化性,稀硫酸不具有氧化性 |
| D.浓硫酸具有腐蚀性,取用时要小心 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com