
| A. | 4.816g | B. | 0.78g | C. | 4.66g | D. | 5.44g |
分析 n[NH4Al(SO4)2]=1mol/L×0.01L=0.01mol,n[Ba(OH)2]=1.2mol/L×0.02L=0.024mol,OH-先和Al3+反应生成Al(OH)3沉淀,后和NH4+反应生成NH3.H2O,NH4Al(SO4)2中n(SO42-)=2n[NH4Al(SO4)2]=0.02mol,n(Al 3+ )=n[NH4Al(SO4)2]=0.01mol,Ba(OH)2中n(Ba 2+ )=n[Ba(OH)2]=0.024mol,n(OH- )=2n[Ba(OH)2]=0.048mol,根据SO42-+Ba2+=BaSO4↓知Ba 2+过量,要以SO42-为标准计算BaSO4质量,根据Al3++3OH-=Al(OH)3↓知,OH-过量,以Al 3+ 为标准计算Al(OH)3质量,据此分析解答.
解答 解:n[NH4Al(SO4)2]=1mol/L×0.01L=0.01mol,n[Ba(OH)2]=1.2mol/L×0.02L=0.024mol,OH-先和Al3+反应生成Al(OH)3沉淀,后和NH4+反应生成NH3.H2O,NH4Al(SO4)2中n(SO42-)=2n[NH4Al(SO4)2]=0.02mol,n(Al 3+ )=n[NH4Al(SO4)2]=0.01mol,Ba(OH)2中n(Ba 2+ )=n[Ba(OH)2]=0.024mol,n(OH- )=2n[Ba(OH)2]=0.048mol,根据SO42-+Ba2+=BaSO4↓知Ba 2+过量,要以SO42-为标准计算BaSO4质量,根据S原子守恒得n(BaSO4)=n(SO42-)=0.02mol,则m(BaSO4)=0.02mol×233g/mol=4.66g;
根据Al3++3OH-=Al(OH)3↓知,OH-过量,以Al 3+ 为标准计算Al(OH)3质量,根据Al原子守恒得n(Al(OH)3)=n(Al 3+)=0.01mol,则m[Al(OH)3]=0.01mol×78g/mol=0.78g,
所以沉淀质量=4.66g+0.78g=5.44g,故选D.
点评 本题考查化学方程式有关计算,为高频考点,明确离子反应先后顺序及氢氧化铝性质是解本题关键,注意以哪种微粒为标准进行计算,为易错题.


科目:高中化学 来源: 题型:解答题
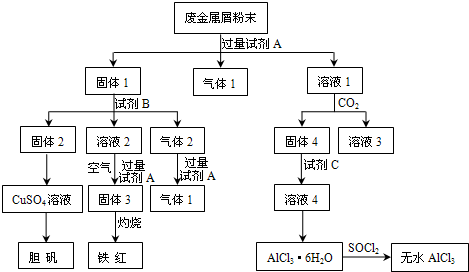
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C16H30O2 | B. | C17H26O4 | C. | C18H28O2 | D. | C17H28O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示关系,其中甲和X可能是( )
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示关系,其中甲和X可能是( )| A. | 甲为C、X为O2 | B. | 甲为Fe、X为Cl2 | C. | 甲为N2、X为O2 | D. | 甲为NaOH、X为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述两个反应都是置换反应 | |
| B. | 反应①中若有1mol Br2生成,则转移电子的物质的量为2mol | |
| C. | 氧化性由强到弱顺序为:KClO3>Cl2>Br2 | |
| D. | 反应②中还原剂与氧化剂的物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| C(H+)mol•L-1 | C(OH-)mol•L-1 | PH | |
| 溶液1 | 1×10-4 | 1×10-10 | 4 |
| 溶液2 | 1×10-7 | 1×10-7 | 7 |
| 溶液3 | 1×10-9 | 1×10-5 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com