
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
分析 减缓反应速率应使盐酸溶液的浓度降低,因铁粉过量,如不影响生成氢气的总量,则所加入物质不能改变酸溶液所能电离出的H+离子总物质的量.
解答 解:①NaOH固体能与盐酸反应,减小生成氢气的总量,故①错误;
②加入硝酸钠固体,在酸性条件下硝酸根离子具有强氧化性,与铁反应生成NO,故②错误;
③加入H2O使盐酸溶液的浓度降低,反应速率减小,且不影响生成氢气的总量,故③正确;
④CH3COONa固体与盐酸反应生成弱电解质,溶液H+离子浓度降低,但不影响生成氢气的总量,故④正确;
⑤加入硫酸钾溶液,浓度减小,反应速率减小,但生成氢气的量不变,故⑤正确;
所以以上正确的有:③④⑤,
故选B.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由盐酸决定,把握浓度对反应速率的影响即可解答,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
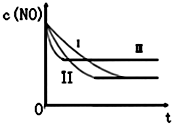 汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
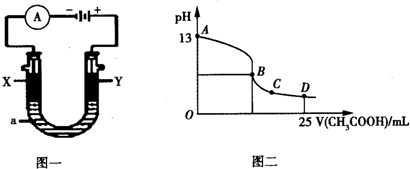
 某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com