
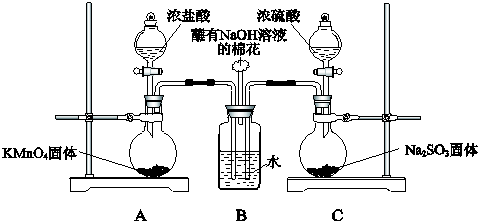
分析 根据装置图分析可知:装置A是制备氯气的发生装置,装置C是制备二氧化硫的发生装置,氯气和二氧化硫通入装置B中的水,是否发生反应,设计实验教学分析验证,实质是二氧化硫和氯气在水中反应生成硫酸和氯化氢,注意氯气中的杂质气体分析和除杂.
(1)所含元素化合价降低的反应物为氧化剂;根据化学方程式中电子守恒计算生成71g Cl2转移的电子物质的量;装置C中浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水;
(2)氯气有毒污染空气,不能排放需要用氢氧化钠吸收剩余氯气;
(3)①二氧化硫和氯气发生氧化还原反应生成了氯化氢,氯离子遇到银离子生成白色沉淀;
②制备氯气中含有氯化氢和水蒸气,氯化氢进入B中溶于水也会生成氯离子,需要在AB间增加一个洗气瓶,用饱和食盐水除去;
③二氧化硫被氯气氧化为硫酸,结合硫酸根离子检验证明二氧化硫和氯气发生了反应.
解答 解:(1)元素化合价升高的失电子做还原剂,元素化合价降低的做氧化剂,装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是KMnO4,生成氯气5mol×71g/mol=355g,电子转移10mol,则生成71g Cl2转移的电子是2mol,装置C中浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,
故答案为:KMnO4;2;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)氯气有毒污染空气,不能排放需要用氢氧化钠吸收剩余氯气,装置B中蘸有NaOH溶液的棉花的作用是吸收氯气尾气处理,防止污染空气,
故答案为:尾气处理,防止污染空气;
(3)①二氧化硫和氯气发生氧化还原反应生成了氯化氢,氯离子遇到银离子生成白色沉淀,向其中滴加少量AgNO3溶液,有白色沉淀生成.甲同学由此认为SO2和Cl2发生了反应的依据是氯气被还原为氯离子,
故答案为:Cl-;
②制备氯气中含有氯化氢和水蒸气,氯化氢进入B中溶于水也会生成氯离子,乙同学认为Cl2中混有的杂质是HCl,需要在AB间增加一个洗气瓶,用饱和食盐水除去,
故答案为:HCl,饱和食盐水;
③二氧化硫被氯气氧化为硫酸,结合硫酸根离子检验证明二氧化硫和氯气发生了反应,丙同学取适量B中溶液于试管中,向其中滴加少量溶液X含钡离子,且不能和二氧化硫发生反应,选项中
a.氯化钡溶液可以检验硫酸根离子存在,证明二氧化硫和氯气发生了反应,故a正确;
b.氢氧化钡和二氧化硫反应生成亚硫酸钡沉淀,不能说明二氧化硫和氯气发生反应,故b错误;
c.硝酸钡溶液中存在硝酸根离子,二氧化硫在溶液中被氧化为硫酸,也会生成硫酸钡沉淀,不能说明二氧化硫和氯气反应,故c错误;
d.氯气和二氧化硫按照1:1通入品红溶液反应,品红溶液不褪色,没有白色沉淀生成,不能证明生成硫酸根,故d错误;SO2与Cl2同时通入水中反应的化学方程式是:SO2+Cl2+2H2O═2HCl+H2SO4
故答案为:a,SO2+Cl2+2H2O═2HCl+H2SO4.
点评 本题考查了化学实验探究,物质性质、反应过程分析、离子检验和实验设计是解题关键,题目难度中等.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题

| A. | 2A+B→2C+Q | B. | 2C→2A+B-Q | C. | 2A(g)+B(g)→2C(g)-Q | D. | 2A(g)+B(g)→2C(g)+Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子比例模型: | B. | 乙烯分子的结构简式为CH2CH2 | ||
| C. | 一氯甲烷的电子式为: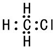 | D. | 2-甲基丁烷的键线式: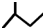 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中金属与非金属的分界线附近可以找到半导体 | |
| B. | 周期表中F是最活泼的非金属,Li是最活泼的金属 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18个纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 | |
| D. | DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
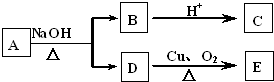
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com