
300℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:
3A(g)+B(g)  2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
(1)300℃时,该反应的平衡常数表达式为:K=___________.
已知K300℃<K350℃,则ΔH________0(填“>”或“<”).
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为______________.
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”、“减小”或“不变”),原因是__________________________________________________.
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各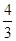 mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________ mol.
mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________ mol.
(共10分,前4空每空各1分,其余每空2分)
(1)K=c2(C)·c2(D)/ c3(A) ·c (B) >
(2) 0.8 mol·L-1 0.2 mol·L-1·min-1
(3)不变 反应前后气体体积不变,压强对平衡无影响 (4) 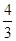
解析试题分析:(1) 化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,300℃时,该反应的平衡常数表达式为K=c2(C)·c2(D)/ c3(A) ·c (B)。如果K300℃<K350℃,这说明升高温度,平衡向正反应方向移动,则ΔH>0。
(2) 3A(g)+B(g)  2C(g)+2D(g)
2C(g)+2D(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) 0.6 0.2 0.4 0.4
平衡浓度(mol/L) 0.4 0.8 0.4 0.4
所以D的平均反应速率为0.4mol/L÷2min=0.2 mol·L-1·min-1
(3)反应前后气体体积不变,压强对平衡无影响,所以若温度不变,缩小容器容积,则A的转化率不变。
(4)如果在相同的条件下,上述反应从逆反应方向进行,则把C、D的量转化为A和B之和应该和最初A、B的物质的量相等。C、D各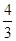 mol完全转化为A是2mol,B是
mol完全转化为A是2mol,B是 ,所以还应该加入B是2mol-
,所以还应该加入B是2mol- =
= 。
。
考点:考查平衡常数的应用、反应速率以及等效平衡的有关计算
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,难易适中。在注重对学生基础性知识巩固和训练的同时,侧重对学生解题方法和能力的培养,有助于培养学生的逻辑推理能力,提高学生的应试能力。该题的难点是等效平衡的判断和有关计算。


科目:高中化学 来源: 题型:
| 活性炭 |
| 1 |
| c(SO2)?c(Cl2) |
| 1 |
| c(SO2)?c(Cl2) |
查看答案和解析>>
科目:高中化学 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
请按要求回答下列问题:
(1)将0.20 mol CH4和0.30 mol H2O(g)通入容积为2 L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如下图.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)________;ΔH1________0,p1________p2(均填“<”、“=”或“>”);p1、100℃时平衡常数的值K=________.

(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.

若在300℃时其他条件不变,将该反应容器容积压缩到原来的1/2,重新平衡时CH3OH的物质的量的变化是________,K的变化是________(均填“增大”,“减小”或“不变”).
(3)已知在常温常压下:2CH3OH(I)+3O2(g)![]() 2CO2(g) ΔH=-1275.6 kJ/mol
2CO2(g) ΔH=-1275.6 kJ/mol
H2O(g)=H2O(I) ΔH=-44.0 kJ/mol,请计算32 g新型燃料甲醇完全燃烧生成液态水放出热量为________kJ.
(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如下图所示,电池工作时电子移动方向是(极板用M、N表示)________,负极电极反应式为________.

若以该燃料电池作为电源,用石墨作电极电解500 mL饱和食盐水,当两极共收集到1.12 L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=________(假设反应前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(X)/ mol·L-1 | c(Y)/ mol·L-1 | v/ mol·L-1·s-1 |
1 | 0.10 | 0.10 | 4.0×10-4 |
2 | 0.20 | 0.10 | 1.6×10-3 |
3 | 0.30 | 0.10 | 3.6×10-3 |
4 | 0.30 | 0.20 | 7.2×10-3 |
根据以上实验数据,完成下列问题:
(1)上述反应在
(2)当c(X)=c(Y)=0.25 mol·L-1时,v=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
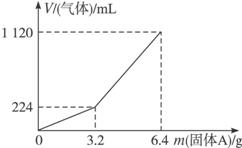
(1)3.2 g固体A中所含的物质有__________;各物质的物质的量分别为__________,溶于上述盐酸充分反应后,所得溶液中溶质的物质的量浓度为(忽略溶液体积变化)__________。
(2)当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=__________mL(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀至 2.12 L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
回答下列问题:
①写出实验①中发生反应的离子方程式___________________________________。
②实验④中V=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com