
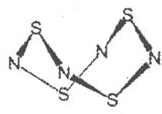
分析 (1)根据晶体的构成微粒确定晶体类型,由分子构成的晶体为分子晶体,由原子构成的晶体为原子晶体;
(2)①同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,铵根离子和酸根离子之间存在离子键,含有孤电子对和含有空轨道的原子之间形成配位键;分子晶体中分子之间存在范德华力;
②根据价层电子对互斥理论确定S原子杂化类型.
解答 解:(1)S4N4的晶体是由分子构成的,属于分子晶体,故答案为:分子晶体;
(2)①该反应6S2Cl2+16NH3=S4N4+S8+12NH4Cl的NH3中含有极性键和范德华力、氯化铵中含有配位键、极性键和离子键,S8中含有范德华力和非极性键,S4N4中含有范德华力和极性键,所以没有破坏或形成的微粒间作用力是金属键,故选d;
②S2Cl2中,其结构式为Cl-S-S-Cl,每个S原子含有两个σ键和两个孤电子对,所以每个S原子价层电子对个数是4,则为sp3杂化,故答案为:sp3.
点评 本题考查晶体类型的判断、原子杂化方式判断、化学键和分子间作用力等知识点,为高考高频点,明确晶体构成微粒与晶体类型的关系、价层电子对互斥理论即可解答,注意配位键也属于共价键,氢键属于分子间作用力.


科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA | |
| D. | 标准状况下,22gCO2气体中含有的σ键和π键的数目均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.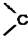 =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$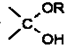 $→_{H+}^{ROH}$
$→_{H+}^{ROH}$ 写出由乙烯、甲醇为有机原料制备化合物
写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2Br•CH2Br.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2Br•CH2Br.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去MgCl2溶液中的Fe3+,可向溶液中加入氨水调节pH | |
| B. | 除去污水中的金属离子Cu2+、Hg2+,可向溶液中加入FeS | |
| C. | 除去Cl2中混有的HCl,可以将气体通入饱和氯化钠溶液 | |
| D. | 除去CaCO3中的少量CaSO4,可以向其中加入足量饱和Na2CO3溶液后过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com