


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
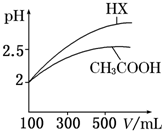 回答下列问题:
回答下列问题:| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 城市 | 污染 指数 |
首要 污染物 |
空气质 量级别 |
城市 | 污染 指数 |
首要 污染物 |
空气质 量级别 |
| 北京 | 92 | TSP | Ⅱ | 济南 | 76 | TSP | Ⅱ |
| 天津 | 82 | TSP | Ⅱ | 武汉 | 83 | NOx | Ⅱ |
| 长春 | 103 | TSP | Ⅲ | 深圳 | 77 | NOx | Ⅱ |
| 上海 | 74 | NOx | Ⅱ | 汕头 | 54 | Ⅱ | |
| 杭州 | 67 | TSP | Ⅱ | 成都 | 87 | TSP | Ⅱ |
| 福州 | 42 | Ⅰ | 重庆 | 98 | SO2 | Ⅱ | |
| 厦门 | 25 | Ⅰ | 贵阳 | 69 | TSP | Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
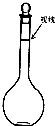 实验室要配制480mL0.2mol/L NaOH溶液,请回答下列问题:
实验室要配制480mL0.2mol/L NaOH溶液,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XH4的沸点比YH3高 |
| B、X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C、元素Y与W形成的化合物溶于水后具有漂白性 |
| D、X与Y形成的化合物可能是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置.可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com