
| A. | ⅢB族 | B. | ⅢA族 | C. | ⅤⅢ族 | D. | 0族 |
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:解答题
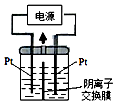 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.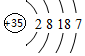 ,碘是紫黑色(填颜色)固体物质.(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq).此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用.
,碘是紫黑色(填颜色)固体物质.(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq).此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 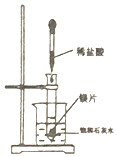 利用图装置,可以研究Ca(OH)2的溶解度随温度的变化 | |
| B. | 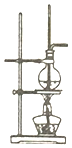 利用图装置,可以利用乙醇制备乙烯 | |
| C. |  利用图装置,可以利用生石灰和NH4C1固体制NH3 | |
| D. | 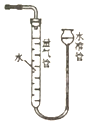 利用图装置,可以测定浓硝酸与铜反应生成的NO2气体体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | H2O和D2O | ||
| C. | O2与O3 | D. | CH3OCH3与CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
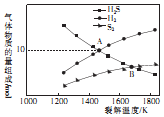 硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.
硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O2与足量KMnO4反应,转移电子数为2NA | |
| B. | 4.4g CO2和N2O的混合气体含有的原子数为0.3NA | |
| C. | 22.4L NH3含有的电子数为10NA | |
| D. | 25℃、101kPa,2.24LCH4含有的共价键数小于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 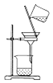 用装置分离Fe(OH)3胶体和NaCl溶液 | |
| B. | 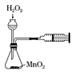 用装置定量测定H2O2的分解速率 | |
| C. |  用装置将CuSO4•5H2O变无水CuSO4 | |
| D. | 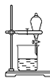 用装置④分离饱和Na2CO3溶液和CH3COOCH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com