
| ||
| ||
| ||
| ||
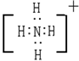 ,OH-离子电子式:
,OH-离子电子式: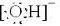 ,
, ;
;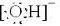 ;
;

科目:高中化学 来源: 题型:
| A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B、钠在氯气中燃烧,生成白色的烟 |
| C、氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
| D、铁在氯气中燃烧和铁与盐酸反应生成的氯化物是一样的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
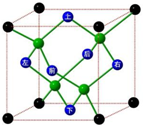 冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
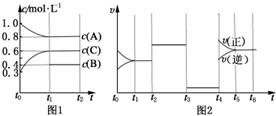 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.查看答案和解析>>
科目:高中化学 来源: 题型:
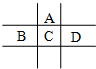 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.查看答案和解析>>
科目:高中化学 来源: 题型:
 由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1mol?L-1的水溶液pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com