
| A. | 第二周期第ⅤA族 | B. | 第三周期第ⅣA族 | C. | 第三周期第ⅥA族 | D. | 第三周期第ⅤA族 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:实验题
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 乙烯的性质与聚乙烯相同 | |
| C. | 乙醇既可以作燃料,也可以在日常生活中使用,如75%的乙醇经常用于医疗上杀菌、消毒 | |
| D. | 蛋白质溶液中分别加入(NH4)2SO4稀溶液和CuSO4溶液,均有沉淀,原理不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 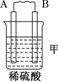 | 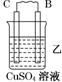 | 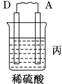 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇是一种可再生能源 | |
| B. | 乙醇只能在实验室内做燃料 | |
| C. | 乙醇易燃烧,污染小 | |
| D. | 目前,粮食作物是制乙醇的重要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{y-2x}{a}$ mol•L-1 | B. | $\frac{y-x}{a}$ mol•L-1 | C. | $\frac{2y-2x}{a}$ mol•L-1 | D. | $\frac{2y-4x}{a}$ mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com