
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
分析 (1)①Ti的质子数为22,根据核外电子排布规律可知其核外电子排布为:[Ar]3d24s2,外围电子排布图为: ;电子占据的最高能层为第四能层,原子轨道数为1+3+5+7=16;
;电子占据的最高能层为第四能层,原子轨道数为1+3+5+7=16;
②根据价层电子对互斥理论确定离子空间构型、B原子的杂化轨道类型;BH4-内部有3个H与B形成极性键,另一个H提供孤对电子,B提供空轨道,从而形成配位键;元素的非金属性越强,其电负性越大;
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)NaH具有NaCl型晶体结构,食盐晶体里Na+和Cl-的间距为棱长的一半,据此分析解答.
解答 解:(1)①Ti的质子数为22,根据核外电子排布规律可知其核外电子排布为:[Ar]3d24s2,外围电子排布图为: ;电子占据的最高能层为第四能层,原子轨道数为1+3+5+7=16;
;电子占据的最高能层为第四能层,原子轨道数为1+3+5+7=16;
故答案为: ;16;
;16;
②BH4-中B原子价层电子数=4+0=4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型;BH4-内部有3个H与B形成极性键,另一个H提供孤对电子,B提供空轨道,从而形成配位键;非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:正四面体;sp3;cd;H>B>Li;
(2)①核外电子排布相同,核电荷数越大,离子半径越小,锂的质子数为3,氢的质子数为1,Li+、H-核外电子数都为2,所以半径Li+<H-,
故答案为:<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,
故答案为:Mg;
(3)NaH具有NaCl型晶体结构,NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为$\frac{488-102×2}{2}$=142pm,该晶胞中钠离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氢离子个数=12×$\frac{1}{4}$+1=4,NaH的理论密度是ρ=$\frac{4M}{{N}_{A}V}$=$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$,
故答案为:142pm;$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断、空间构型的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 有机高分子化合物被称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而得到的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构很复杂 | |
| C. | 对于一块高分子材料来说,n是一个整数值,因而它的相对分子质量是确定的. | |
| D. | 材料可分为天然高分子材料和合成高分子材料两大类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、CO2、CO、S晶体类型相同 | |
| D. | 22.4 L OCS中约含有3×6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
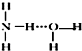 …”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为
…”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为| A. | ②⑥ | B. | ①②⑥ | C. | ②⑤⑥⑧ | D. | ③④⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液可作外伤止血剂,其原理与胶体知识有关 | |
| B. | C单质可在高温下被浓H2SO4和浓HNO3氧化,而Si 单质不与任何酸反应 | |
| C. | SiO2 分子的空间构型为四面体空间网状结构,因此SiO2晶体硬度大,熔沸点高 | |
| D. | 标准状况下,22.4LSO2和SO3的混合物所含分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com