
�Ȼ�����һ����Ҫ�Ļ���ԭ�ϣ���ˮ�Ȼ�������ʪ����������ˮ����FeCl3��nH2O��
��1��ʵ����������װ�ã����ּ��ȡ��гֵ�װ������ȥ���Ʊ���ˮ�Ȼ������塣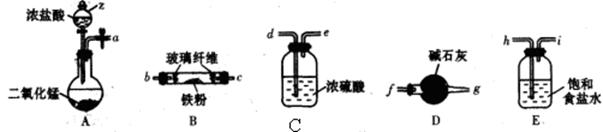
��װ��A������z��������___________��
�ڼ�������װ��A�����ԵIJ�����______________________��
�۰������������Ӹ������ӿڣ�˳��Ϊa��_________ ��__________ ��_________ ��__________��b��c��_________��__________��װ��D��������______________________��
��2����ҵ���Ʊ���ˮ�Ȼ�����һ�ֹ����������£�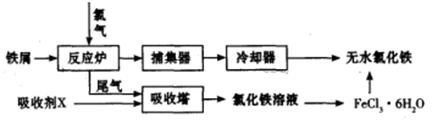
���������з�����Ӧ�����ӷ���ʽΪ_________________________________________��
�ڼ�����FeCl3��6H2O����õ���ˮ�Ȼ����IJ�����________________________________��
���õ������ⶨ������ˮ�Ȼ�����������������ȡm����ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100 mL����ƿ�У�������ˮ���ݣ�ȡ��10 mL�������Թ�����KI��Һ����ַ�Ӧ����ָʾ��_________�����Լ����ƣ�����c mol/L��Na2S2O3��Һ���еζ����յ�ʱ����V mLNa2S2O3��Һ����֪��I2��2S2O32����2I����S4O62����������Ʒ���Ȼ�������������Ϊ____________��
��3������֪��
Fe(OH)3(aq) Fe3��(aq)��3OH��(aq) ��H��a kJ/mol
Fe3��(aq)��3OH��(aq) ��H��a kJ/mol
H2O(l) H��(aq)��OH��(aq) ��H��b kJ/mol
H��(aq)��OH��(aq) ��H��b kJ/mol
��д��Fe3������ˮ�ⷴӦ���Ȼ�ѧ����ʽ________________________________________��
��16�֣���1���ٷ�Һ©����1�֣�д���ֲ��÷֣�
�ڹر�a�����ɼкͷ�Һ©���Ļ��������Һ©���м���϶��ˮ��Ȼ���Һ©���Ļ�����ʹˮ�������£�����Һ©���е�ˮ������ȫ©�£�˵��װ�������Ժã�����a�ܴ���һ���ܣ���������ĩ�˲���ˮ�У�ͬʱ�رշ�Һ©���Ļ������þƾ��Ƹ�Բ����ƿ�ȣ�������ĩ��������ð����ֹͣ���Ȼָ�����ʱ������ĩ���γ�һС��ˮ����˵��װ�������Ժá���2�֣������𰸼��ɣ���a��h��i��d��e��b��c��f��g (2�֣�˳��д�����÷�) ����δ��Ӧ��Cl2 (1��)��ͬʱ��ֹ�����е�ˮ��������װ��B (1��) (��2�֣������𰸼���)
��2����2Fe2++Cl2=2Fe3++2Cl- ��2�֣���ѧʽд��������ƽ�����÷֣�д��ѧ����ʽ���÷֣�
�ڽ�FeCl3��6H2O��������HCl�����м���(2�֣������𰸼���)
�۵�����Һ����� (1��) 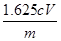 %��
%��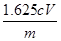 ��
��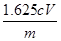 ��100% (2�֣������𰸼���)
��100% (2�֣������𰸼���)
��3��Fe3+(aq)+3H2O(l) Fe(OH)3(aq) + 3H+(aq) ��H=��3b��a��kJ��mol-1 ��2�֣���ѧʽд��������ʽд��������ƽ��©д����״̬��©д��λ�����÷֣�
Fe(OH)3(aq) + 3H+(aq) ��H=��3b��a��kJ��mol-1 ��2�֣���ѧʽд��������ʽд��������ƽ��©д����״̬��©д��λ�����÷֣�
���������������1���ٸ���װ�õĽṹ�ص���жϣ�װ��A������z�������Ƿ�Һ©����
��װ�������Լ���һ���ǽ�������ѹ���˸��ݸ�װ�õ��ص��֪������װ��A�����ԵIJ���Ӧ���ǹر�a�����ɼкͷ�Һ©���Ļ��������Һ©���м���϶��ˮ��Ȼ���Һ©���Ļ�����ʹˮ�������£�����Һ©���е�ˮ������ȫ©�£�˵��װ�������Ժã�����a�ܴ���һ���ܣ���������ĩ�˲���ˮ�У�ͬʱ�رշ�Һ©���Ļ������þƾ��Ƹ�Բ����ƿ�ȣ�������ĩ��������ð����ֹͣ���Ȼָ�����ʱ������ĩ���γ�һС��ˮ����˵��װ�������Ժá�
��������ˮ�Ȼ�������ʪ����������ˮ����FeCl3��nH2O�����Ƶõ������к���ˮ�������Ȼ��⣬�����ں�����Ӧ֮ǰ��Ҫ�����������Ȼ����ñ���ʳ��ˮ��ȥ��Ũ�����������������������ȳ�ȥ�Ȼ��⣬�����ͬʱΪ�˷�ֹ������Ⱦ��������ҲΪ�˷�ֹ�����е�ˮ�������뷴Ӧ��������Ҫ��β������װ�ã�ѡ���װ����ʢ�м�ʯ�ҵĸ���ܣ�������ȷ������˳��Ϊa��h��i��d��e��b��c��f��g���������Ϸ�����֪��װ��D������������δ��Ӧ��Cl2��ͬʱ��ֹ�����е�ˮ��������װ��B��
��2���ٴ��������г��������Ȼ�����Һ���������ռ�XӦ�����Ȼ����������Ը÷�Ӧ�����ӷ���ʽΪ2Fe2++Cl2=2Fe3++2Cl-��
�������Ȼ���ˮ�����������������Ȼ��⣬ˮ�����ȣ������ɵ� �Ȼ��⼫�ӷ�����һ���ٽ�ˮ�⣬������FeCl3��6H2O����õ���ˮ�Ȼ����IJ���Ӧ���ǽ�FeCl3��6H2O��������HCl�����м��ȣ�
���Ȼ����ܰѵ⻯���������ɵ��ʵ⣬��������������ɫ�����Լ����ָʾ��Ӧ���ǵ�����Һ�����ݷ���ʽ2Fe3����2I����2Fe2����I2��I2��2S2O32����2I����S4O62����֪2Fe3����I2��2S2O32������10ml��Һ�������ӵ����ʵ�����0.001cVmol������ԭ��Ʒ���Ȼ��������ʵ�����0.001cVmol�� ��0.01cVmol������Ȼ�����������0.01cVmol��162.5g/mol��1.625cVg������Ʒ���Ȼ�������������Ϊ
��0.01cVmol������Ȼ�����������0.01cVmol��162.5g/mol��1.625cVg������Ʒ���Ȼ�������������Ϊ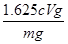 ��100%��
��100%��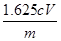 %��
%��
��3����֪��Fe(OH)3(aq) Fe3��(aq)��3OH��(aq) ��H��a kJ/mol����H2O(l)
Fe3��(aq)��3OH��(aq) ��H��a kJ/mol����H2O(l) H��(aq)��OH��(aq) ��H��b kJ/mol������ݸ�˹���ɿ�֪�ڡ�3���ټ��õ�����ʽ��Fe3+(aq)+3H2O(l)
H��(aq)��OH��(aq) ��H��b kJ/mol������ݸ�˹���ɿ�֪�ڡ�3���ټ��õ�����ʽ��Fe3+(aq)+3H2O(l) Fe(OH)3(aq) + 3H+(aq)�����Ը÷�Ӧ�ķ�Ӧ�ȡ�H=��3b��a��kJ��mol-1��
Fe(OH)3(aq) + 3H+(aq)�����Ը÷�Ӧ�ķ�Ӧ�ȡ�H=��3b��a��kJ��mol-1��
���㣺��������ʶ�������Լ��顢�����Ʊ���������β��������ˮ��Ӧ�á����ʺ����ⶨ��ʵ�鷽���������㣻��˹���ɵ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���û�ѧ��Ӧԭ���о��������ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮
��1�����������У�SO2����������SO3��2SO2��g��+O2��g�� 2SO3��g���������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ1��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
2SO3��g���������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ1��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺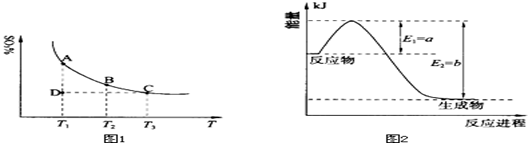
�ٺ��¡���ѹ�����£���Ӧ2SO2��g��+O2��g�� 2SO3��g����ƽ�⣬����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ���������
2SO3��g����ƽ�⣬����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ���������
�����¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1 K2�����������������=������ͬ��������Ӧ���е�״̬Dʱ��v�� v�������������������=������ͬ����
��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
����ͼ2��һ�����¶Ⱥ�ѹǿ����N2��H2��Ӧ����1molNH3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ��Ӧ����ʽ�� ��
����H����ֵ�ú���ĸa��b�Ĵ���ʽ��ʾ��
�ڰ�������ˮ�õ���ˮ����25���£���a mol?L-1�İ�ˮ��b mol?L-1������������ϣ���Ӧ����Һǡ�������ԣ��ú�a��b�Ĵ���ʽ��ʾ����ˮ�ĵ���ƽ�ⳣ������ʽ ��
��3����֪25��CʱKsp[AgCl]=1.6��10-10mol2?L-2��Ksp[AgI]=1.5��10-16mol2?L-2������25���£���0.1L0.002mol?L-1��NaCl��Һ����μ���0.1L0.002mol?L-1��������Һ���а�ɫ�������ɣ��ӳ����ܽ�ƽ��ĽǶȽ��Ͳ���������ԭ���� ����Ӧ�����Һ�У���������0.1L0.002mol?L-1��NaI ��Һ�������������� �������������ԭ���ǣ������ӷ���ʽ��ʾ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����ʹ�������Դ����չ����̼���á�����Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1������ˮ����ת������H2����Ҫת����Ӧ���£�
CH4(g) + H2O(g) CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
������Ӧ����ԭ�����е�CO��ʹ�ϳɰ��Ĵ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ���Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2�������״���ԭ��CO��H2��Դ�ڣ�CH4(g) + H2O(g)  CO(g) + 3H2(g) ��H>0
CO(g) + 3H2(g) ��H>0
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ___________��(�<������>������="��" )��
��100��ʱ����1 mol CH4��2 mol H2Oͨ���ݻ�Ϊ1 L�Ķ����ܷ������У�������Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________
a�������������ܶȺ㶨
b����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2
c��������ѹǿ�㶨
d��3v��(CH4) = v��(H2)
��3��25��ʱ����20mL0��1mol/L������м���VmL0��1mol/LNaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����_____��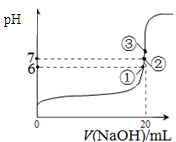
A��pH��3��HF��Һ��pH��11��NaF��Һ�У� ��ˮ�������c(H+)���
B���ٵ�ʱpH��6����ʱ��Һ�У�c(F��)��c(Na+)��9��9��10-7mol/L
C���ڵ�ʱ����Һ�е�c(F��)��c(Na+)
D���۵�ʱV��20mL����ʱ��Һ��c(Na+)��0��1mol/L
��4������������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH��O��F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2SO2��g����O2��g��=2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2��g������Ϊ1 mol SO3��g���Ħ�H����99 kJ��mol��1����ش��������⣺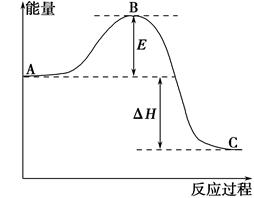
��1��ͼ��A��C�ֱ��ʾ________��________��
��2��E��ʾ________��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ��________����С����ޡ���Ӱ�졣
��3���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��H________����������С�����䡱����������_____________________________________��
��4��ͼ�Ц�H��________kJ��mol��1��
��5����֪�������ȼ����Ϊ296 kJ��mol��1��������S��s������3 mol SO3��g���Ħ�H��________��Ҫ�������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2013�괺����ȫ�����س����������ص����������������ǵ�������������������ص�Ӱ�졣����β���к���CO����������̳�����Ⱦ��ǵ�������������ԭ��֮һ����ش������й����⡣
(1)����˵����ȷ����________��
A��NO��CO��CO2������������
B��CO2�Ĵ����ŷŻᵼ������ЧӦ������Ӧ����ѡ�ù�����ͨ���ᳫ��̼��
��
C������β���еĵ���������Ҫ�ǿ����еĵ����������ڸ������������ɵ�
(2)Ϊ������Ⱦ������Ϊ������װ�ˡ���Ч�������������ɽ�β���е�CO��NOת��Ϊ�������ѭ������������壬��Ӧ���£�2NO��2CO N2��2CO2����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________��
N2��2CO2����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________��
(3)��֪�����Ȼ�ѧ����ʽ��
N2(g)��O2(g)=2NO(g)����H����180.5 kJ��mol��1��
2C(s)��O2(g)=2CO(g)����H����221.0 kJ��mol��1��
C(s)��O2(g)=CO2(g)����H����393.5 kJ��mol��1��
������β��ת����Ӧ2NO(g)��2CO(g) N2(g)��2CO2(g)�Ħ�H��________��
N2(g)��2CO2(g)�Ħ�H��________��
(4)�������������һ��ʱ�������������ɼӿ컯ѧ��Ӧ���ʡ���ͼ��ʾ��������������ʱ����Ӧ2NO(g)��2CO(g) N2(g)��2CO2(g)��NO��Ũ��[c(NO)]���¶�(T)�����������(S)��ʱ��(t)�ı仯���ߡ�
N2(g)��2CO2(g)��NO��Ũ��[c(NO)]���¶�(T)�����������(S)��ʱ��(t)�ı仯���ߡ�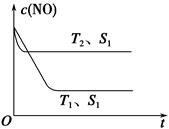
��ͼ��T1________T2(�>����<��)��
���������ı����S1>S2����ͼ�л���c(NO)��T1��S2�����´ﵽƽ������еı仯���ߡ�
(5)�����������������ڴ������ַ����еĵ�����������Ļ�ѧ��ӦΪ2NH3(g)��NO(g)��NO2(g) 2N2(g)��3H2O(g)����H<0���ں��ݵ��ܱ������У������й�˵����ȷ����________��
2N2(g)��3H2O(g)����H<0���ں��ݵ��ܱ������У������й�˵����ȷ����________��
A����Ӧ��ÿת��3 mol���ӣ����ɱ�״����N2�����Ϊ22.4 L
B��ƽ��ʱ���������������䣬����NH3��Ũ�ȣ������е��������ת����
��С
C����Ϊ��Ӧ�������������ʵ����٣����Է�Ӧ����������������
D��������������ʱ��ʹ�ø�Ч�����������е��������ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
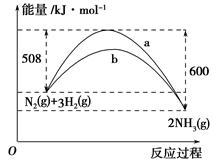
(1)�ٸ�������ͼʾ��д����Ӧ���Ȼ�ѧ����ʽ___________________________��
�ڸ�����ͼ��ʾ������ж�����˵������ȷ����________��
| A�����Ȼ�ѧ����ʽΪ��CO(g)��H2O(g)=CO2(g)��H2(g)����H��41 kJ��mol��1 |
| B���÷�ӦΪ���ȷ�Ӧ |
| C���÷�ӦΪ���ȷ�Ӧ |
| D����H2OΪҺ̬ʱ���䷴Ӧ��ֵС��41 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2013��ȫ�����ض�������ʮ�������������У�������β����ȼú�����������Կ����������ϴ�
��1������β����������Ҫԭ��Ϊ��2NO(g) + 2CO(g) 2CO2(g)+ N2(g)����H��0
2CO2(g)+ N2(g)����H��0
���÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ���
����ͼ�Ц�����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
��2��������β����úȼ�ղ����������������������CH4����ԭNOX�������������������Ⱦ����֪��CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g) ��H����867 kJ/mol
2NO2(g) N2O4(g) ��H����56.9 kJ/mol
N2O4(g) ��H����56.9 kJ/mol
H2O(g) �� H2O(l) ��H �� ��44.0 kJ��mol
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ�� ��
��3����NH3����ԭNOXҲ�������������������Ⱦ����ͼ������NH3����ԭ����������һ��������ͨ�����ֲ�ͬ�����������ݳ������е������ﺬ�����Ӷ�ȷ�������ѵ��ʣ�ע���ѵ��ʼ���������ת���ʣ���
��Ӧԭ��Ϊ��NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)��
2N2(g) + 3H2O(g)��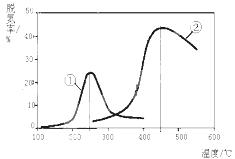
�ٸ÷�Ӧ�ġ�S 0����H 0����������������� ����������
�ڶ������巴Ӧ����ij���(B)��ƽ��ѹǿ(pB)�������ʵ���Ũ��(cB)Ҳ���Ա�ʾƽ�ⳣ��������KP����
��������Ӧ��KP�� ��
������˵����ȷ���� ��
A���ڢ��ִ����ȵڢ��ִ����ѵ��ʸ�
B����ͬ�����£��ı�ѹǿ���ѵ���û��Ӱ��
C�������١��ڷֱ��ʺ���250���450�������ѵ�
��4��NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ����ͼ���õ����ʹ�ù�����ʯīI�缫������������Y����缫��ӦΪ ��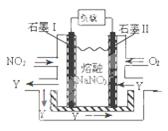
��5�����Ṥҵβ���е������NO��NO2���������ء�CO(NH2)2����Һ��ȥ����Ӧ���ɶԴ�������Ⱦ�����塣1 mol���������չ�ҵβ���е����������NO��NO2�����Ϊ1:1��������Ϊ___________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ڡ�ʮ���塱�ڼ佫SO2���ŷ�������8%���о�SO2�ۺ����������ش�
��1����֪25��ʱ��SO2��g����2CO��g����2CO2��g����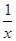 Sx��s�� ��H��akJ/mol
Sx��s�� ��H��akJ/mol
2COS��g����SO2��g����2CO2��g����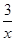 Sx��s�� ��H��bkJ/mol��
Sx��s�� ��H��bkJ/mol��
��CO��Sx����COS��Ӧ���Ȼ�ѧ����ʽ��________________________��
��2���������밴��ͼ��ʾװ���÷����е�SO2�������ᡣ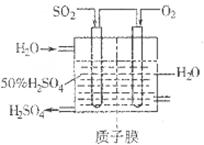
д��SO2�缫�ĵ缫��Ӧʽ__________________________��
��3����߷�Ӧ2SO2��g����O2��g��  2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽����
2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽����
��T1�¶�ʱ����2L���ܱ������м���4.0molSO2��2.0molO2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%��ǰ5 min��SO2��ƽ����Ӧ����Ϊ___________��
���ڢ��еķ�Ӧ�ﵽƽ��ı�������������ʹSO2��ת���ʼ�SO3��ƽ��Ũ�ȶ���ԭ���������
_________������ţ���
a���¶Ⱥ�����������䣬����1.0molHe ��g��
b���¶Ⱥ�����������䣬����2molSO2��lmolO2
c���¶Ⱥ�����������䣬����1.0molSO2
d����������������ʱ����С�������ݻ�
���������������������£�̽����ʼʱ�������ʵ�����2SO2��g����O2��g��  2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������
2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������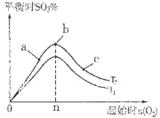
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ϊ����������������ԴΣ����ר���������̫���ܴ�ʹȼ��ѭ��ʹ�õĹ��룬ת����ϵ��ͼ��ʾ��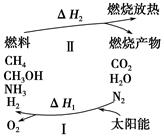
��֪��
(1)���̢�������·�Ӧ��ʾ����2CO2 2CO��O2
2CO��O2
��2H2O(g) 2H2��O2
2H2��O2
��2N2��6H2O 4NH3��3O2
4NH3��3O2
��2CO2��4H2O 2CH3OH��3O2
2CH3OH��3O2
��2CO��4H2O ________��3O2��
________��3O2��
(2)25 ��ʱ��a g CH4��ȫȼ���ͷų�b kJ����������˵������ȷ����(����)��
| A�����̢��ǽ�̫����ת���ɻ�ѧ�� |
| B����Ӧ�ݵ���һ�ֲ���ΪCH4 |
| C����H1������H2 |
| D����ʾ����ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽΪCH4(g)��2O2(g)=CO2(g)��2H2O(l)����H����16b kJ��mol��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com