
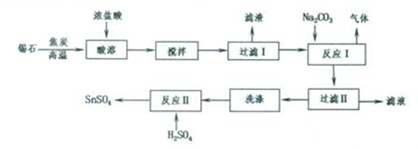
分析 SnO2粉末在高温度下与焦炭反应得到金属锡,加浓盐酸进行溶解并过滤得到SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)Sn2+有强还原性,在酸性条件先易被空气中的O2氧化成Sn4+,可结合电子守恒、电荷守恒及原子守恒配平得相应的离子反应方程式;
(2)过滤Ⅱ得到沉淀是SnO,可知反应Ⅰ中Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(3)沉淀表面附着液中含有Cl-,只要设计实验检验最后一次洗涤液里不含有Cl-,即可证明沉淀洗涤干净;
(4)电镀池通过待镀金属作阴极,镀层金属作阴极,且阴极上发生还原反应析出镀层金属;
(5)等浓度Sn2+、Sn4+的混合溶液中通入足量的H2S,沉淀时需要S2-最小的离子最先沉淀;可Ksp(SnS)=1×10-25,Ksp(SnS2)=2×10-27,计算当溶液中c(S2-)=c mol•L-1时溶液中所含Sn2+、Sn4+的浓度,再计算浓度的比值;
(6)根据①Sn+2H+=Sn2++H2↑;②FeCl3:Sn2++2Fe3+=Sn4++2Fe2+;③6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;建立关系式3Sn~6Fe2+~Cr2O72-;由此可根据消耗的K2Cr2O7的物质的量计算样品中Sn的物质的量,最终计算出样品的质量分数.
解答 解:SnO2粉末在高温度下与焦炭反应得到金属锡,加浓盐酸进行溶解并过滤得到SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)在酸性条件Sn2+被空气中的O2氧化成Sn4+,发生反应的离子反应方程式为:2Sn2++O2+4H+=2Sn4++2H2O;故答案为:2Sn2++O2+4H+=2Sn4++2H2O;
(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,反应方程式为:SnCl2+Na2CO3═SnO↓+CO2↑+2NaCl↑,
故答案为:SnCl2+Na2CO3═SnO↓+CO2↑+2NaCl;
(3)取最后一次洗涤液适量于试管中并滴加稀硝酸酸化,然后滴加硝酸银溶液,无白色沉淀,证明沉淀洗涤干净,若有白色沉淀生成,可证明洗涤液里含有Cl-,沉淀洗涤不干净;故答案为:取最后一次洗涤液适量于试管中并滴加稀硝酸酸化,然后滴加硝酸银溶液,无白色沉淀,证明沉淀洗涤干净;
(4)在铁制品表面镀锡时,阴极为铁,发生电极反应为Sn2++2e-=Sn,故答案为:阴;Sn2++2e-=Sn;
(5)设浓度均为1mol/L的Sn2+、Sn4+的混合溶液中,根据Ksp(SnS)=1×10-25,Ksp(SnS2)=2×10-27,可知SnS开始沉淀时所需要c(S2-)=1×10-25mol/L,SnS2开始沉淀时所需要c(S2-)=$\sqrt{2×1{0}^{-27}}$mol/L,故Sn2+最先沉淀;当溶液中c(S2-)=c mol•L-1时,溶液中c(Sn2+)=$\frac{1×1{0}^{-25}}{cmol/L}$;c(Sn4+)=$\frac{2×1{0}^{-27}}{{c}^{2}(mol/L)}$,则$\frac{S{n}^{2+}}{S{n}^{4+}}=\frac{\frac{1×1{0}^{-25}}{c}}{\frac{2×1{0}^{-27}}{{C}^{2}}}=50c$,故答案为:Sn2+;50c;
(6)0.1000mol•L-1 K2Cr2O7溶液20.00mL中Cr2O72-的物质的量为0.1000mol•L-1×0.02L=0.002mol;根据关系式3Sn~6Fe2+~Cr2O72-可知Sn的物质的量为0.002mol×3=0.006mol,则样品的质量分数为$\frac{0.006mol×119g/mol}{0.800g}×100%$=89.25%,故答案为:89.25%.
点评 本题SnSO4制备的之比为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写、滴定应用及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:填空题
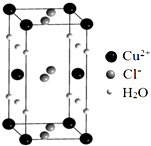 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
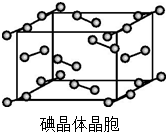 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.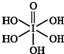 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
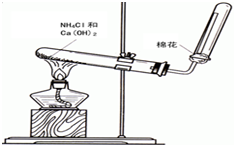 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
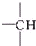 和
和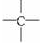 等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.
等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C中含有14个中子 | |
| B. | 1H、2H、3H是同一种核素 | |
| C. | H2O与D2O(重水)互称同位素 | |
| D. | C60、C70、金刚石、石墨均为碳的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
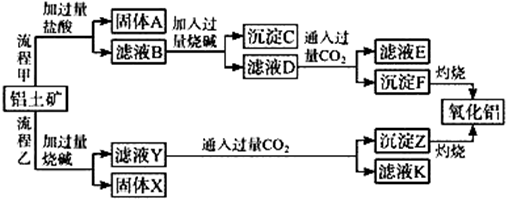
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com