
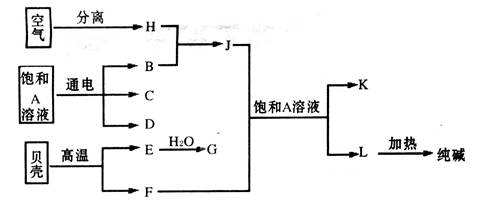

 (2分)
(2分) Cl2↑+H2↑+2NaOH;故答案为:2NaOH+2H2O
Cl2↑+H2↑+2NaOH;故答案为:2NaOH+2H2O Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH; 2NH3,正反应方向是放热反应,气体体积减小的反应;
2NH3,正反应方向是放热反应,气体体积减小的反应; ×100%=
×100%= ×100%;故答案为:
×100%;故答案为: ×100%;
×100%;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:不详 题型:单选题
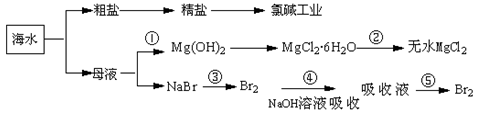
| A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应 |
| B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2 |
| C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2 |
| D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
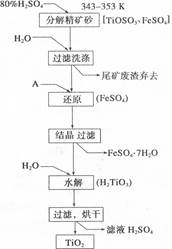
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶剂萃取脱硫法 |
| B.煤的气化(产物主要为CO和H2) |
| C.借助高温和催化剂的作用,使煤在氢压下裂解成小分子的烃类液体燃料 |
| D.煤的直接燃烧 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2NaCl(熔融) 2Na + Cl2↑ 2Na + Cl2↑ |
| B.Al2O3 +3C ="====" 2Al + 3CO↑ |
C.Fe2O3 + 3CO  2Fe + 3CO2↑ 2Fe + 3CO2↑ |
D.2Ag2O 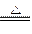 4Ag + O2↑ 4Ag + O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因海水中含有镁元素,故不需经过化学变化就可以得到金属镁 |
| B.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得钠 |
| C.乙烯、丙烯、甲烷等主要化工基本原料都可以由石油分馏得到 |
| D.煤的干馏是化学变化,石油的分馏是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com