
| A. | B、C、D形成的简单离子,半径最小的是B | |
| B. | E形成最简单氢化物稳定性比B强 | |
| C. | A、C、D形成的最高价氧化物的水化物两两间可相互反应 | |
| D. | A、B形成的化合物与B、E形成的化合物化学键类型相同 |
分析 A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,B、E是同一主族元素,则B处于第二周期、E处于第三周期,E元素的最外层电子是次外层电子数的0.75倍,最外层电子数为8×0.75=6,故E为S元素,则B为O元素;C原子半径大于所在同周期中其它主族元素的原子半径,则C为Na;D元素的最外层电子数等于其电子层数,则D为Al;其中A的最高正价与最低负价的代数和等于0,则A为C元素(一般不考虑H元素),据此解答.
解答 解:A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,B、E是同一主族元素,则B处于第二周期、E处于第三周期,E元素的最外层电子是次外层电子数的0.75倍,最外层电子数为8×0.75=6,故E为S元素,则B为O元素;C原子半径大于所在同周期中其它主族元素的原子半径,则C为Na;D元素的最外层电子数等于其电子层数,则D为Al;其中A的最高正价与最低负价的代数和等于0,则A为C元素(一般不考虑H元素).
A.B、C、D形成的简单离子分别为O2-、Na+、Al3+,离子电子层结构相同,核电荷数越大离子半径越小,故O2-离子半径最大,Al3+离子半径最小,故A错误;
B.非金属性B(O)>E(S),故E形成最简单氢化物稳定性比B弱,故B错误;
C.A、C、D形成的最高价氧化物的水化物分别为碳酸、氢氧化钠、氢氧化铝,碳酸与氢氧化铝不能反应,故C错误;
D.A、B形成的化合物有CO、CO2,B、E形成的化合物SO2,SO3,均只含有共价键,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意H元素最高正价与最低负价的代数和也等于0,中学一般不考虑.


科目:高中化学 来源: 题型:选择题
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
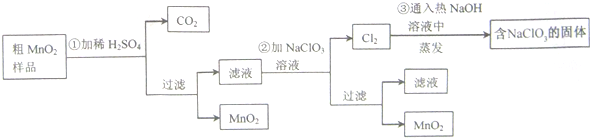
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸 | B. | 金刚石和石墨 | ||
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{17}$O | D. | CH3CH2CH2CH3和 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氧化剂是氯酸钾,还原产物是Cl2.
,氧化剂是氯酸钾,还原产物是Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
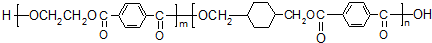
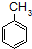 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$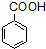
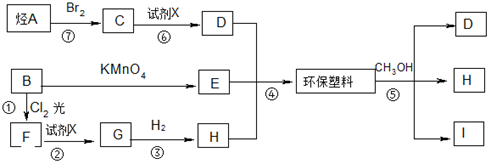
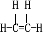 ;
;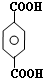 ;B的名称:对二甲苯,试剂X为NaOH水溶液.
;B的名称:对二甲苯,试剂X为NaOH水溶液.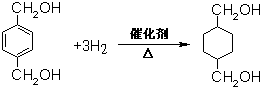 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com