
在Na2CO3中加醋酸产生CO2气体,试从电离平衡常数的角度解释原因[已知:K(CH3COOH)=1.7×10-5;K(H2CO3)=4.3×10-7。]:_____________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
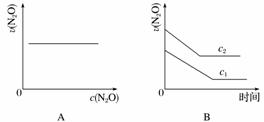
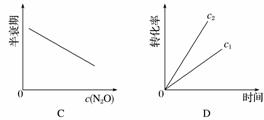
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
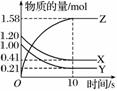
(1)从反应开始到10 s时,用Z表示的反应速率为__________,X的物质的量浓度减少了________,Y的转化率为______。
(2)该反应的化学方程式为______________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______。
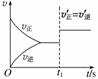
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
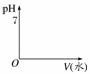
按要求画出图像,并回答下列问题。
(1)相同体积、相同浓度的盐酸和醋酸
①加入足量的Zn,在甲图中画出H2体积的变化图像

甲 乙
单位时间内,________产生的H2多,反应停止时,产生的H2________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH( )
(2013·重庆理综,2B)
(2)稀醋酸加水稀释,醋酸的电离程度增大,溶液的pH减小( )
(2012·重庆理综,10B)
(3)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
(4)CH3COOH溶液加水稀释后,溶液中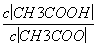 的值减小( )
的值减小( )
(2013·江苏,11C)
(5)室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH )·c(OH-)变大( )
)·c(OH-)变大( )
(2013·福建理综,8B)
查看答案和解析>>
科目:高中化学 来源: 题型:
常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
| 温度(℃) | c(NH3·H2O) (mol·L-1) | 电离常数 | 电离度(%) | c(OH-) (mol·L-1) |
| 0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:电离度= ×100%
×100%
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是______(填字母)。
a.电离常数 b.电离度
c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是______________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小
C.c(OH-)减小 D.c(NH )减小
)减小
(4)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH )与c(Cl-)比值变大的是______。
)与c(Cl-)比值变大的是______。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.原子晶体中的各相邻原子都以共价键相结合
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com