
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
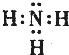 ,稳定性最强的氢化物的结构式为H-O-H;
,稳定性最强的氢化物的结构式为H-O-H; .
. 分析 第二、三周期元素中,①③均有+1价,处于IA族,原子半径①>③,则①为Na、③为Li;⑤⑦均有+5、-3价,原子半径⑤>⑦,则⑤为P元素、⑦为N元素;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;④有+3价,处于ⅢA族,原子半径大于P,故④为Al;⑥有+7、-1价,则⑥为Cl;⑧有-2价,处于VIA族,原子半径小于氯,故⑧为O元素,以此解答该题.
解答 解:第二、三周期元素中,①③均有+1价,处于IA族,原子半径①>③,则①为Na、③为Li;⑤⑦均有+5、-3价,原子半径⑤>⑦,则⑤为P元素、⑦为N元素;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;④有+3价,处于ⅢA族,原子半径大于P,故④为Al;⑥有+7、-1价,则⑥为Cl;⑧有-2价,处于VIA族,原子半径小于氯,故⑧为O元素,
(1)⑧为O元素,在元素周期表中的位置是:第二周期VIA族,
故答案为:第二周期VIA族;
(2)8个元素的最高价氧化物的水化物中,酸性最强的是HClO4,
故答案为:HClO4;
(3)⑦为N元素,对应的氢化物为氨气,电子式为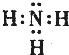 ,非金属性O>N>P,氢化物最稳定的为水,结构式为H-O-H,
,非金属性O>N>P,氢化物最稳定的为水,结构式为H-O-H,
故答案为: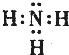 ;H-O-H;
;H-O-H;
(4)①、④的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,氢氧化铝具有两性,与氢氧化钠反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)①元素和⑥元素形成化合物为NaCl,用电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期表和元素周期律,为高频考点,利用表中元素的性质来推断元素是解答本题的关键,并熟悉元素周期律来解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
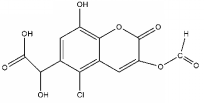
| A. | 能发生加成、取代、氧化反应 | |
| B. | 1 mol该物质最多可与7mol NaOH反应 | |
| C. | 1 mol该物质最多可与6 mol H2反应 | |
| D. | 能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: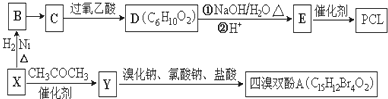
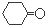

 .
.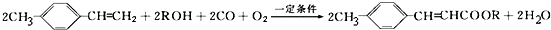
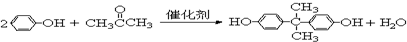
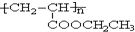 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: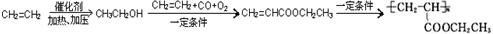 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
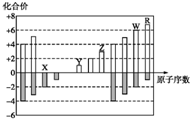
| A. | 离子原子半径:X2->Y+>Z3+ | |
| B. | 气态氢化物的沸点:X>R | |
| C. | 最高价氧化物的水化物的酸性:W>R | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com